D1-UE7-Guiraud

UE7 – Génétique Pr. Pascale GUIRAUD
Date : 25/01/15 Plage horaire : 8h30-10h30
Promo : 2014/2015
Ronéistes : VENTURINI Yann
LAVAUD Aurore
Introduction à la génétique médicale et chromosomes
humains
I. Introduction
1. Généralités
A. Importance de la génétique en médecine
B. Lexique (Elle ne commente pas ces rappels de base.)
2. Maladies génétiques et mutations
A. Incidence des maladies génétiques
B. Exemples d’incidence de maladies génétiques les plus fréquentes
C. Classification des maladies génétiques
3. Génétique médicale
A. A quoi sert la génétique médicale ?
B. Consultation génétique et conseil génétique
4. Rappels sur l’organisation de l’information génétique
A. Que trouve-ton dans une cellule ?
B. Organisation de l’information génétique
II. Le caryotype
1. Généralités
A. Définitions
B. Les caractéristiques du caryotype
C. Techniques d’études
2. Protocole
A. 1ère étape : culture cellulaire
B. 2ème étape : arrêt de la culture
C. 3ème étape : choc hypotonique
D. 4ème étape : fixation des préparations métaphasiques
E. 5ème étape : étalement des préparations chromosomiques sur lame
F. 6ème étape : coloration
G. 7ème étape : analyse et traitement des images
3. Structure des chromosomes
A. Constrictions
B. Centromères
C. ADN satellites
D. Télomères
4. Critères d’identification des chromosomes
A. Généralités
B. Technique des bandes
C. Nomenclature
5. Le caryotype humain
A. Classification des chromosomes
B. Techniques de coloration
6. Anomalies du caryotype
7. Indication de caryotype à basse et haute résolution
A. Indication du caryotype (liste non exhaustive) : quand est-ce que l’on fera un caryotype ?
B. Indication du caryotype à haute résolution

I. Introduction
1. Généralités
A. Importance de la génétique en médecine
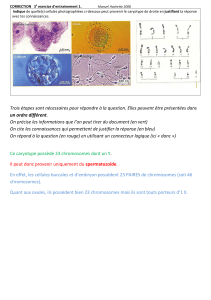
On considère qu’environ :
50% des fausses-couches du trimestre 1 (T1) sont dues à une ou plusieurs anomalies
chromosomiques du fœtus.
2% des pathologies congénitales "majeures" ont des facteurs génétiques pour origine.
Pathologie congénitale = toute anomalie constatée à la naissance, sans préjuger de son
origine génétique. 98% des pathologies congénitales ne sont donc pas d’origine
génétique.
50% de retard mental sévère, de surdité congénitale ou de cécité de l'enfant sont dus à une cause
génétique.
Le diabète, l’hypertension, les thromboses, l’obésité… sont dues à des facteurs génétiques.
10% des cancers fréquents (intestin, sein, ovaires) de l'adulte ont une origine génétique.
B. Lexique (Elle ne commente pas ces rappels de base.)
- Gène : segment d'ADN qui code pour une protéine.
- Génome : ensemble des gènes contenus dans une cellule.
- Génétique : tout ce qui est en lien avec la constitution génique.
- Héréditaire : qui peut se transmettre de génération en génération.
- Congénital : présent à la naissance mais n’est pas forcément lié à une anomalie génétique.
- Sporadique/ de novo : caractérise en général une mutation et signifie « qui arrive pour la première fois ».
- Homozygote/ hétérozygote : Le terme homozygote s’utilise lorsque qu’un individu possède deux mêmes
allèles d’un même gène. En revanche un individu est hétérozygote lorsque celui- ci possède deux allèles
différents pour un même gène. Ce nombre variable d’allèles pour un même gène dérive du polymorphisme.
- Syndrome : ensemble de signes rattachés à une même cause, qu'elle soit connue ou suspectée.
2. Maladies génétiques et mutations
A. Incidence des maladies génétiques
A titre d’exemple, on sait que :
Il existe plus de 7000 maladies génétiques connues. Toutefois, une majeure partie d’entre elles
concerne des maladies rares.
Les maladies génétiques peuvent apparaitre très tôt ou à l’âge adulte.
Chaque être humain est porteur en moyenne de 5 à 10 anomalies génétiques asymptomatiques.
Il existe un certain nombre de gènes qui sont mutés sans présenter pour autant de phénotype connu à l’état
hétérozygote (parmi ces mutations on peut citer en exemple la mucoviscidose qui touche 1 individu sur 20).
On considère que chaque humain porte au moins 1 à 3 mutations récessives. Mais il y existe aussi d’autres
remaniements comme des translocations équilibrées qui peuvent également passer inaperçu. Les
translocations équilibrées concernent 1 individu sur 250.
B. Exemples d’incidence de maladies génétiques les plus fréquentes
Chez l’adulte
Chez l’enfant
Hypercholestérolémie familiale : 1/200
Cancer du sein d’origine génétique : 5 à 10%
Cancer du côlon d’origine génétique : 5 à 8%
Hémochromatose : 1/400.
Trisomie 21 : 1/800
Mucoviscidose : 1/2500
Amyotrophie spinale : 1/3000
Surdités congénitales : 1/3000

C. Classification des maladies génétiques
3. Génétique médicale
A. A quoi sert la génétique médicale ?
Tout d’abord, la génétique médicale comprend la génétique clinique, organisée autour de consultations de
génétique. Ces consultations servent à :
Etablir un diagnostic clinique avec l’aide des généticiens et de l’équipe soignante ;
Informer le patient sur sa pathologie et assurer le soutien de celui-ci ainsi que de sa famille ;
La participation des équipes médicales à une prise en charge médicale et socioéducative.
Dans le cas des grossesses futures, l’inquiétude des familles nécessite l’apport de conseils et d’explications
sur les risques de récurrences par exemple. Il est important d’informer les mamans sur les possibilités et les
limites du diagnostic anténatal. Ainsi, on observe souvent une évolution vers un aspect de « conseil
génétique » qui permet d’orienter les familles.
Pour la famille, la génétique médicale permet d’organiser un dépistage des personnes à risque.
Enfin, la génétique médicale est également caractérisée par la génétique biologique, dont le but est de poser
un diagnostic. La génétique biologique met en œuvre :
la cytogénétique (pour les anomalies chromosomiques),
la biologie moléculaire (pour les mutations ponctuelles),
la biochimie (pour les analyses fonctionnelles des protéines anormales).
Suivant le diagnostic établi, on peut proposer des thérapeutiques spécifiques.
B. Consultation génétique et conseil génétique
La consultation génétique permet d’identifier une cause génétique potentielle.
En parallèle, le conseil génétique, concernant les patients ou des apparentés à risque d’une maladie
génétique, consiste à les informer sur :
la nature, la cause, et les conséquences de la maladie ;
la probabilité de la développer ou de la transmettre ;
les moyens de la prévenir, dépister ou de l’améliorer ;
les options pour la prise en charge ;
les options pour un projet de conception futur.
4. Rappels sur l’organisation de l’information génétique
A. Que trouve-ton dans une cellule ?
Les anomalies conduisant à des maladies génétiques peuvent porter sur :
L’ADN du noyau (hérédité conventionnelle) ou des mitochondries (hérédité non conventionnelle).
L’ARN du noyau ou cytoplasme (issus de la transcription d’un ADN anormal).
Les protéines (issues de la traduction d’un ARN anormal).
Anomalies chromosomiques (grossières)
Anomalies géniques (ponctuelles)
- Numériques
- Structurelles
- Monogéniques (touchent un seul gène)
- Polygéniques (touchent plusieurs gènes)
- Multifactorielles (la maladie ne se déclenche qu’en cas
de facteur(s) associé(s), environnementaux notamment)

Le caryotype humain comprend 46 chromosomes.
L’ensemble de l’ADN d’une cellule humaine déroulé
mesure jusqu’à 2 mètres et porte 30 000 gènes codant
pour des protéines.
B. Organisation de l’information génétique
L’information génétique est répartie sur 46 chromosomes (soit 23
paires de chromosomes). Le nombre de bases de l’ADN est estimé à 3
000 Mb (3 milliards de bases).
En moyenne, sur un chromosome, on peut retrouver 150 Mb (150
millions de bases) qui forment 250 à 2500 gènes.
Dans une bande chromosomique, on dénombre 50 gènes. Une bande
peut faire jusqu’à 5 Mb (5 millions des bases).
Le génome mitochondrial porte également des gènes fondamentaux
susceptibles d’être touchés par des mutations.
II. Le caryotype
1. Généralités
Les chromosomes sont des unités visibles au microscope optique au moment de la mitose (en raison de la
forte condensation de la chromatine).
Le chromosome mitotique est formé de deux chromatides identiques appelées chromatides sœurs qui
persistent jusqu’à la fin de la métaphase.
On peut parler de chromosome tout au long du cycle cellulaire : le chromosome mitotique est la forme
condensée du chromosome interphasique. Pour analyser les chromosomes et déterminer des anomalies
chromosomiques, on procède au caryotype.

Caryotype normal : Femme 46, XX Caryotype normal : Homme 46, XY
On peut observer qu’il y a un classement des chromosomes par paires en fonction de leur taille, de la
position du centromère… Les chromosomes présentés ici sont caractérisés par une coloration hétérogène
due à des méthodes de coloration particulières.
Les chromosomes sexuels sont toujours positionnés à la fin.
A. Définitions
Cytogénétique : spécialité médicale qui étudie la morphologie du matériel génétique se présentant sous
forme de chromosomes compacts (chez la cellule eucaryote).
Caryotype : consiste en un dénombrement et une identification de tous les chromosomes d’une cellule chez
un individu. En général, l’analyse se déroule en métaphase (caryotype classique). On peut également
réaliser le caryotype en pré-métaphase ou prophase pour augmenter la résolution et le niveau de détail
(caryotype à haute résolution). A ce moment- là, les chromosomes sont moins compactés, on obtient donc
plus de bandes.
B. Les caractéristiques du caryotype
Le caryotype correspond au nombre de chromosomes d’une cellule.
Il présente un nombre de chromosomes identique pour toutes les cellules d’un même organisme (à
l’exception des gamètes bien sûr !).
Il est constant pour les individus d’une même espèce et est caractéristique de l’espèce.
Il peut servir à mettre en évidence des anomalies de nombre ou de structure.
Le caryotype ne permet pas de détecter des mutations ponctuelles, mises en évidence par des techniques de
biologie moléculaire.
Nombres chromosomiques diploïdes de quelques espèces (à titre indicatif !).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%