8a-DST-mars

V. MICHAU (TS1 : 33 élèves) J. ASTOLFI (TS3 : 33 élèves) M. KOUKABI (TS5 : 33 élèves)
V. DEUTSCH (TS2 : 31 élèves) B. BERNE (TS4 : 33 élèves)
D.S.T.
PHYSIQUE – CHIMIE
Série S
____
DURÉE DU DEVOIR : 2 heures
____
L’usage d’une calculatrice est autorisé
____
Lundi 9 mars 2015
____
EXERCICE 1 : Lancement d’un satellite météorologique
EXERCICE 2 : Des molécules odorantes
Les 2 exercices peuvent être réalisés dans l’ordre de votre choix.

EXERCICE 1 : Lancement d’un satellite météorologique (12 points)
Le centre spatial de Kourou a lancé le 21 décembre 2005, avec une fusée Ariane 5, un satellite de
météorologie de seconde génération baptisé MSG-2. Tout comme ses prédécesseurs, il est placé sur une
orbite géostationnaire à 36 000 km d'altitude. Opérationnel depuis juillet 2006, il porte maintenant le
nom de Météosat 9.
Les satellites de seconde génération sont actuellement les plus performants au monde dans le domaine
de l'imagerie météorologique. Ils assureront jusqu'en 2018 la fourniture de données météorologiques,
climatiques et environnementales.
D’après plusieurs sites Internet.
L'objectif de cet exercice est d'étudier plusieurs étapes de la mise en orbite de ce satellite.
Les parties 1 et 2 de cet exercice sont indépendantes.
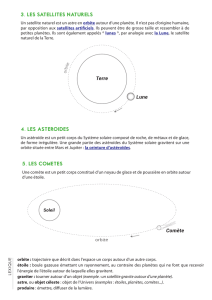
Dans cet exercice, on suppose que la Terre est une sphère de centre T, de masse MT , de rayon RT et
qu'elle présente une répartition de masse à symétrie sphérique. On assimile par ailleurs le satellite à son
centre d'inertie S. L’étude de son mouvement se fait dans un référentiel géocentrique supposé galiléen.
Données : Masse de la Terre : MT = 6,0
10 24 kg
Rayon de la Terre : RT = 6,4
10 3 km
Constante de gravitation universelle : G = 6,67
10 –11 kg –1.m 3.s -2
Partie 1 : Mise en orbite basse du satellite
La mise en orbite complète du satellite MSG-2 de masse m = 2,0 10 3 kg s'accomplit en deux étapes.
Dans un premier temps, il est placé sur une orbite circulaire à vitesse constante VS à basse altitude
h = 6,0
10 2 km autour de la Terre (voir la figure 1 page 3) et il n'est soumis qu’à la force
gravitationnelle exercée par la Terre.
On choisit un repère de Frenet ( S,
t
,
n
) dans lequel
t
est un vecteur unitaire tangent à la trajectoire
dans le sens du mouvement et
n
un vecteur unitaire perpendiculaire à la trajectoire orienté vers le
centre de la Terre. On rappelle que dans un repère de Frenet, l’accélération d’un système a pour
expression :
nataa nt
..
avec
dt
dv
at
et
r
v
an
2
r
étant le rayon de la trajectoire.
1.1.
Sans aucun souci d'échelle, représenter sur un schéma, à un instant de date
t
quelconque, la
Terre, le satellite, le repère (
S
,
t
,
n
) ainsi que la force gravitationnelle
T/S
F
exercée par la Terre
sur le satellite. Établir son expression vectorielle en fonction des données de l’énoncé.
1.2. En appliquant une loi de Newton, trouver l'expression du vecteur accélération
s
a
du centre
d'inertie du satellite.
1.3. Sans souci d'échelle, représenter sur le schéma précédent le vecteur accélération
s
a
.
1.4. Déterminer l'expression de la vitesse VS
du centre d'inertie du satellite
.
Vérifier que sa valeur
est de l’ordre de 7,6
10 3 m.s–1 sur son orbite basse.

1.5. On note T le temps mis par le satellite pour faire un tour autour de la Terre. Comment
appelle-t-on cette grandeur ?
Montrer qu'elle
vérifie la relation :
T
T
MG hR
T.).(432
2
.
Partie 2 : Transfert du satellite en orbite géostationnaire
Une fois le satellite MSG-2 placé sur son orbite circulaire basse, on le fait passer sur une orbite
géostationnaire à l'altitude h' = 3,6
10 4 km. Ce transit s'opère sur une orbite de transfert qui est
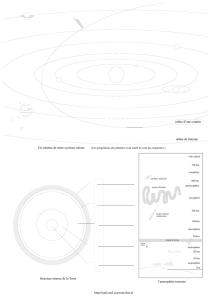
elliptique. Le schéma de principe est représenté sur la figure 1 ci-dessous.
Le périgée P est sur l'orbite circulaire basse et l'apogée A est sur l'orbite définitive géostationnaire.
À un moment convenu, lorsque le satellite est au point P de son orbite circulaire basse, on augmente sa
vitesse de façon bien précise : il décrit ainsi une orbite elliptique de transfert afin que l'apogée A de
l'ellipse soit sur l'orbite géostationnaire définitive. On utilise pour cela un petit réacteur qui émet en P,
pendant un très court instant, un jet de gaz donnant au satellite l'impulsion nécessaire.
2.1. Énoncer la deuxième loi de Kepler, ou « loi des aires ».
2.2. Montrer, en s’aidant éventuellement d’un schéma, que la vitesse du satellite MSG-2 n'est pas
constante sur son orbite de transfert.
Préciser en quels points de son orbite de transfert sa vitesse est maximale et minimale.
2.3. Exprimer la distance
AP
en fonction de
R
T,
h
et
h'
. Montrer que
AP
= 4,9
10 7 m.
2.4. Dans le cas de cette orbite elliptique, la durée de révolution pour faire un tour complet de
l’orbite vaut T ’ = 10 h 42 min. Déterminer la durée minimale t du transfert du satellite MSG-2 du
point P de son orbite basse au point A de son orbite géostationnaire définitive.
Le satellite étant arrivé au point A, on augmente à nouveau sa vitesse pour qu'il décrive ensuite son
orbite géostationnaire définitive. Le lancement complet du satellite est alors achevé et le processus
permettant de le rendre opérationnel peut débuter.
2.5. Interpréter qualitativement le rôle du petit réacteur émettant un jet de gaz en P et en A.
Orbite géostationnaire
définitive
altitude
h' = 3,6
10 4 km
Orbite circulaire basse
altitude
h = 6,0
10 2 km
Orbite
de transfert elliptique
Figure 1
P
A
Terre

EXERCICE 2 : Des molécules odorantes (8 points)
Les esters ont souvent une odeur agréable. On les trouve naturellement dans les fruits dont ils sont
souvent responsables de l'arôme. La parfumerie et l'industrie alimentaire utilisent aussi les esters et
les obtiennent par extraction ou par synthèse.
Ester
Odeur
méthanoate d'éthyle
fruitée
méthanoate de butyle
fruitée
éthanoate de méthyle
méthyle
fruitée
éthanoate de propyle
poire
De tous temps, certains « nez » éduqués ont été capables de distinguer des odeurs très voisines
et d'identifier ainsi des esters. De nos jours, les espèces organiques peuvent être identifiées par des
méthodes spectroscopiques (infrarouge, résonance magnétique nucléaire, etc.).
Il est relativement aisé de passer d'un produit ayant une odeur âcre, comme l'acide formique, à
l'odeur fruitée d'un ester. C'est ce qu'illustre le protocole décrit ci-après de la synthèse du
méthanoate de butyle à partir de l'acide formique.
Protocole
Préparer un bain-marie à une température d'environ 50 °C. Sous la
hotte, verser dans un erlenmeyer 7,5 mL d'acide formique, puis
18,0 mL de butan-1-ol, ajouter 3 gouttes d'acide sulfurique concentré.
Surmonter l'erlenmeyer contenant le mélange d'un réfrigérant à air, le
placer dans le bain-marie et assurer une agitation douce.
L'équation de la réaction de synthèse est :
HC OH + OH CH2 CH2 CH2 CH3 HC O CH2 CH2 CH2 CH3 + H2O
acide formique butan-1-ol méthanoate de butyle eau
Données :
Espèce chimique
Masse molaire moléculaire (g.mol1)
Densité
acide formique
46,0
1,22
butan-1-ol
74,0
0,81
-
masse volumique de l’eau : eau = 1,0 g.mL1
-
numéros atomiques : Z(C) = 6 ; Z(O) = 8.
O
O
Ester
Odeur
éthanoate de butyle
pomme
éthanoate d'octyle
orange
propanoate d'éthyle
fraise
butanoate d'éthyle
ananas

On se propose d’étudier les caractéristiques de la synthèse du méthanoate de butyle à partir de
l’acide formique puis d’identifier des esters.
Le candidat utilisera ses connaissances ainsi que les informations fournies dans les documents.
1- Réaction de synthèse du méthanoate de butyle
1.1. Quel est le nom en nomenclature officielle de l'acide formique ?
1.2. Recopier l'équation de la réaction de synthèse étudiée en utilisant une écriture topologique.
Encadrer les groupes caractéristiques et nommer les fonctions correspondantes.
2- Optimisation du protocole de synthèse
2.1. Le mélange de réactifs dans le protocole décrit est-il stœchiométrique ? Justifier.
2.2. Identifier dans le DOCUMENT 1, la courbe correspondant au protocole décrit. Justifier.
2.3. En analysant les différentes courbes des documents 1a et 1b, présenter en les justifiant les
conditions optimales de la synthèse du méthanoate d’étyle.
2.4. La synthèse permet d’obtenir 0,13 mole d’ester. La réaction est–elle totale ? Justifier.
3- Identification des réactifs et des produits par spectroscopie
Lors d’une analyse spectroscopique par infrarouge, une onde de longueur d’onde d’énergie E est envoyée
sur l’échantillon à analyser. Le spectre infrarouge montre alors des bandes d’absorption pour certains
nombres d’onde.
3.1. Rappeler l’expression du nombre d’onde σ.
3.2. Le DOCUMENT 2 présente deux spectres infrarouges correspondant aux deux réactifs de la
synthèse du méthanoate de butyle. Identifier à quelle espèce chimique correspond chacun des spectres
A et B. On justifiera clairement le choix en s’aidant du tableau du DOCUMENT 3.
La distinction des esters par l'odeur peut être incertaine, en particulier dans le cas du méthanoate d'éthyle
et de l'éthanoate de méthyle.
3.3. Ecrire les formules semi-développées du méthanoate d'éthyle et de l'éthanoate de méthyle.
3.4. La spectroscopie IR permet-elle de distinguer ces 2 esters ? Justifier.
Pour distinguer les molécules ces deux esters, on propose d’étudier leurs spectres de RMN.
3.5. Associer chacun des spectres du DOCUMENT 4 à l'ester correspondant. Justifier clairement
votre choix.
 6
6
 7
7
 8
8
1
/
8
100%