Développement de la charnière crânio-rachidienne

article original
Développement de la charnière crânio-rachidienne
C. Morgand, M. Catala
Laboratoire d’Histologie et Embryologie et UMR CNRS 7000
Faculté de Médecine Pitié-Salpêtrière - Université Pierre et Marie Curie
105, Bd de l’Hôpital - 75634 Paris Cedex 13
5
DOSSIER
RACHIS - Vol. 17, n°1, Mars 2005
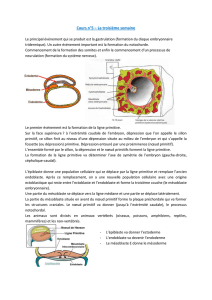
Lacharnière crânio-rachidienne est une structu-
re complexe tant sur le plan anatomique
qu’embryologique. Elle a subi de profonds
remaniements au cours de la phylogénèse pour s’a-
dapter aux contraintes mécaniques inhérentes au
mode de vie des mammifères. L’embryogénèse de la
charnière crânio-rachidienne est indissociable du
mésoderme para-axial, tissu dérivé de la gastrulation.
Anatomiquement, l’os occipital est décrit sous la
forme de quatre sous-unités (basi-occipital, exo-occi-
pital, supra-occipital et interpariétal). En fait, il faut
d’emblée séparer l’os interpariétal qui appartient à la
voûte du crâne du reste de la charnière qui est une
véritable interface entre le chondrocrâne et le rachis.
Le « chondro-occipital » et les deux premières vertèb-
res cervicales dérivent du mésoderme para-axial. Il
existe encoredes controverses quant aux participa-
tions exactes des somites occipitaux et cervicaux pour
la genèse de ces os. On commence à mettreen éviden-
ce des gènes impliqués dans le contrôle de la morpho-
The cranio-spinal junction is a complex anato-
mical region prone to malformations. In order
to understand how these malformations arise,
it is mandatory to know the phases taking place during
the normal development. A tremendous amount of data
is nowavailable thanks to the different animal models
that can be used in Developmental Biology. The cra-
nio-spinal junction has been dramaticallymodified
during the evolution from fishes to mammals. The
eventual anatomical aspect is adapted for the human
way of life. It is necessary to work on the development
of the para-axial mesoderm in order to understand the
mechanisms that lead to the formation of the bones
constituting the junction. The para-axial mesoderm is
aprimordial layer that is settled down during gastru-
lation. This event takes place during the third week of
gestation in humans. This mesoderm is organized into
domains: a rostral one, namely the cephalic mesoderm
that stays unsegmented, and a caudal one constituted
by metameric units, the somites. Eachsomite dissocia-
Résumé Summary

Lacharnière crânio-rachidienne représente un
véritable défi biomécanique. En effet, la mobi-
lité de cet ensemble doit être importante pour
l’appréhension visuelle de l’environnement (détection
d’une proie potentielle en vue de la nutrition, et repé-
rage d’un individu hostile potentiellement dangereux).
Mais cette charnière doit aussi être résistante car les
éléments du système nerveux central inclus dans le
canal central jouent un rôle vital primordial (moelle
allongée, moelle cervicale haute). La charnière crânio-
rachidienne représente l’interface entre les os du crâne
(c’est à dire l’os occipital à ce niveau) et les deux pre-
mières vertèbres cervicales.
Phylogénèse
La charnière crânio-rachidienne est une structure ana-
tomique ayant considérablement évolué au cours de la
phylogénèse des vertébrés. Chez les poissons, les ver-
tèbres ne présentent pas de caractères régionaux et il
n’est donc pas possible de décrire différentes régions
6
C. Morgand, M. Catala
RACHIS - Vol. 17, n°1, Mars 2005
Key-words : Somites - Sclerotome - Hox genes - Development - Cell
interactions.
Mots-clefs : Somites - Sclérotome - Gènes Hox - Développement -
Interactions cellulaires.
génèse de cette région. Les gènes Hox contrôlent l’i-
dentité positionnelle selon l’axe antéro-postérieur.
D’autres gènes contrôlent plus spécifiquement cer-
tains des éléments osseux de cette région. Toutes ces
données devraient être utilisées pour une meilleure
lecture intégrée des malformations de la charnière.
tes to form three derivatives: the sclerotome, the myo-
tome and the dermatome. The axial skeleton derives
from the sclerotome.
It is commonly accepted in anatomical textbooks that
the occipital bone is built from four primordia (basi-
occipital, exo-occipital, supra-occipital and interpa-
rietal bones). It is important to remain that the inter-
parietal bone belongs to the skull vault and is derived
from neural crest cells contrarily to the other parts of
the occipital bone. The cranio-spinal junction is thus
constituted by the occipital part of the chondrocra-
nium and represents a genuine interface between the
skull and the spine. The “chondro-occipital” and the
first and second vertebrae derive from the para-axial
mesoderm. The fate mapping of this region has been
performed only in avian embryos using the quail-chick
chimeratechnique. However, the results published by
two different groups are divergent. It seems that the
somites represent the major source of cells forming the
chondro-occipital. A contribution from the cephalic
mesoderm is still plausible.
Nowadays, some genetic factors involved in the
control of the development of this junction begin to be
unravelled. Hox genes play a crucial role in establis-
hing a positional identity of the cells according to the
antero-posterior axis. Other genes seem to control
very specific regions of the occipital bones. In the next
future, the understanding of the development of this
region will be clearer allowing proposing new lectures
of human malformations affections the cranio-spinal
junction.

7
Développement de la charnière crânio-rachidienne
RACHIS - Vol. 17, n°1, Mars 2005
spinales. Avec le développement des premiers tétrapo-
des terrestres, une des contraintes à laquelle se sont
trouvés confrontés ces animaux a été la possibilité de
pouvoir relever la tête afin de permettre une meilleure
appréhension visuelle de l’environnement. Cet avan-
tage adaptatif est une acquisition majeure tant pour les
prédateurs que pour les proies. Cette acquisition s’est
traduite par une régionalisation des vertèbres : cervi-
cales rostrales, thoraciques, lombo-sacrées et cauda-
les. Le rachis cervical a pour particularité d’être très
mobile assurant l’érection de la tête et des yeux au-
dessus du plan du sol.
La mobilité de ces régions s’est considérablement
accrue au cours de l’évolution. Ainsi, les reptiles et les
oiseaux ont une articulation crânio-rachidienne à un
seul degré de liberté. Au contraire, les mammifères
jouissent d’une articulation très mobile dans les trois
plans de l’espace.
Les somites,
le sclérotome et le
mésoderme céphalique
Somites, sclérotomes et mésoderme céphalique, pré-
curseurs des éléments squelettiques rachidiens et de
certains os du crâne, dérivent du mésoderme para-
axial. Ce tissu se met en place lors de la troisième
semaine du développement chez l’homme au cours de
la gastrulation (voir 4 pour une revue). Le mésoderme
provient de cellules situées initialement au niveau de la
ligne primitive. La partie la plus rostrale du mésoder-
me para-axial forme le mésoderme céphalique qui ne
se segmente pas. Caudalement, le mésoderme para-
axial forme des structures segmentées, les somites
(figures 1 et 2). Les somites se forment selon un gra-
dient rostro-caudal chez l’homme comme dans toutes
les espèces vertébrées. Le nombre total de somites a
été diversement apprécié par les différents auteurs des
traités d’embryologie humaine classique et ces chiffres
ne sont donnés qu’à titre indicatif pour nos lecteurs :
40 pour Tuchmann-Duplessis (24), 42 à 44 pour
Rabineau (20), Sadler (22), Larsen (13), Encha-Razavi
et Escudier (7), Moore et Persaud (17). Toutefois, ce
nombre est discuté et il serait plus proche de 38 ou 39
selon O’Rahillyet Müller (18) d’après une étude basée
sur l’observation des embryons de la collection de
l’Institut Carnegie et qui, de ce fait, représente plus de
valeurs à nos yeux.
Figure1:Vue dorsale de l’extrémité céphalique d’un embryon de poulet
présentant 16 paires de somites. Le tube neural est segmenté selon l’axe
antéro-postérieur : Tél (télencéphale), Di (diencéphale), M (mésencépha-
le), Rh (rhombencéphale). La vésicule otique (Vo), précurseur de l’oreille
interne et les vésicules optiques (Op), précurseur de la rétine sont bien
visibles. Le mésoderme céphalique est segmenté en somites (So) au niveau
caudal alors que son extrémité céphalique (MC) reste insegmentée.
Figure2:Coupe transverse d’un embryon de poulet présentant 11 paires
de somites et colorée par le violet de crésyl. Ce stade montrel’aspect his-
tologqiue du somite (So). Ao : aorte,En : endoderme,ES : ectoderme de
surface,n:notochorde,TN : tube neural.

8
C. Morgand, M. Catala
RACHIS - Vol. 17, n°1, Mars 2005
Par la suite, les somites se dissocient selon l’axe dorso-
ventral (figure 3). Ils génèrent ainsi trois dérivés (voir
2pour une revue) : le dermatome, dorsal à l’origine du
derme et de l’hypoderme de la région dorsale du
corps, le myotome, intermédiaire, qui donne naissance
aux fibres musculaires striées squelettiques et le sclé-
rotome, tissu le plus ventral à l’origine des vertèbres,
des ligaments, des méninges spinales et d’une partie
des côtes. Le devenir d’un somite n’est pas fixé selon
l’axedorso-ventral : en effet, si on inverse la polarité
d’un somite, de telle sorte que l’hémisomite ventral
occupe une position dorsale et que l’hémisomite dor-
sal occupe une position ventrale, on constate que les
tissus se différencient selon leur nouvel environne-
ment (3). Des études récentes montrent que le myoto-
me est le premier tissu à se spécifier et que le dermo-
tome et le sclérotome restent plastiques plus long-
temps.
Le sclérotome joue un rôle majeur dans la formation
des os de l’axe médian de l’organisme. Ce dérivé
somitique est induit par la notochorde (mésoderme
axial) et par le plancher du tube neural sous l’influen-
ce de la molécule sécrétée Sonic Hedgehog (SHH). Le
signal SHH est très complexe (1); en effet, la cellule
qui synthétise cette protéine génère un précurseur
clivé en deux régions dont une est modifiée (par gref-
fe de deux groupements, un cholestérol et un radical
palmytoil). Le fragment modifié est sécrété et agit sur
un complexe de récepteurs membranaires composés de
Patched,molécule à 12 domaines transmembranaires
et de Smoothened, récepteur à 7 domaines transmem-
branaires. En absence de SHH, Patched inhibe
Smoothened. SHH inhibe Patched et libère donc
Smoothened. Ceci conduit à des modifications de pro-
téines cytoplasmiques Gli (dont il existe trois formes
chez les vertébrés). Ces modifications entraînent l’ac-
tion nucléaire des Gli qui modulent la transcription
génomique.
La greffe de notochorde (ou de toute autre source de
SHH) à proximité de la région dorsale du somite induit
le développement de cellules du sclérotome. Les cel-
lules du sclérotome expriment un facteur de transcrip-
tion nommé Pax1 qui est impliqué dans la différencia-
tion des tissus en cartilage et dans la formation des
vertèbres (23). La molécule SHH serait donc respon-
sable de l’activation de Pax 1 et impliquée par consé-
quent dans la détermination de ce tissu en cartilage
puis en vertèbre.
Un autre dérivé mésodermique intervient dans la for-
mation du crâne : le mésoderme céphalique (figure 1).
Situé en position antérieure par rapport à la formation
des somites dans le mésoderme, ce tissu embryonnai-
re est à l’origine de la formation de nombreux dérivés
tels que les muscles de la face, certains muscles ocu-
laires extrinsèques et certains os de la face ; les autres
os de la face dérivant des cellules des crêtes neurales
céphaliques. Les cellules des crêtes neurales migrent à
partir du toit du tube neural et forment les arcs pha-
ryngés ainsi que le bourgeon naso-frontal, à l’origine
des différentes structures de la face. Seules les cellules
des crêtes neurales céphaliques peuvent générer du
tissu qui est normalement dérivé du mésoderme (on
parle de mésectoderme pour décrire les cellules més-
enchymateuses dérivant des crêtes neurales). Les cel-
lules des crêtes neurales du corps à l’exception de la
tête sont à l’origine de cellules gliales et neuronales et
de mélanocytes mais sont incapables de donner du
tissu osseux ou cartilagineux.
Une lecture anatomique
de l’os occipital
La description classique des anatomistes montre que
l’os occipital est, chez les vertébrés supérieurs, consti-
tué de quatre sous-unités qui sont : le basi-occipital,
l’exo-occipital, le supra-occipital et l’interpariétal
(voir 19 et 21 pour revues). On peut raisonnablement
s’interroger quant à cette description tranchée pour
laquelle les éléments constitutifs de l’os occipital
représentent des entités morphogénétiques différentes.
L’analyse de l’apparition des points d’ossification per-
met de comprendre cette partition. Pourtant, l’ossifi-
Figure 3 : Coupe transverse d’un embryon de poulet présentant 24 paires
de somites et colorée par le violet de crésyl. Ce stade montre la dissocia-
tion somitique en dematome (De), myotome (My) et sclérotome (Scl). Ao :
aorte, ES : ectoderme de surface, n : notochorde, TN : tube neural.

9
Développement de la charnière crânio-rachidienne
RACHIS - Vol. 17, n°1, Mars 2005
cation est un processus tardif qui ne préjuge en rien
des données embryologiques. Ainsi, le basi-occipital,
l’exo-occipital et le supra-occipital dérivent à partir
d’une matrice cartilagineuse unique (ossification
endochondrale) alors que l’interpariétal est un os de
membrane (19). De plus, la matrice cartilagineuse pri-
mordiale ne permet en aucun cas de reconnaître les
différents éléments que sont les compartiments dérivés
du cartilage. Il nous paraît beaucoup plus rigoureux et
plus proche de la réalité d’opposer un chondro-occipi-
tal (composé du basi-occipital, de l’exo-occipital et du
supra-occipital) qui s’intègre au chondro-crâne et un
inter-pariétal qui est un des os de la voûte crânienne et
qui dérive des cellules de la crête neurale (10).
Vers une lecture
embryologique de la
charnière crânio-
rachidienne
L’étude précoce de l’origine embryonnaire des cellules
qui contribuent à la formation de la charnière crânio-
rachidienne n’a été réalisée que chez l’oiseau (6, 8).
Ces deux auteurs ont utilisé la technique des chimères
caille - poulet décrite par Nicole Le Douarin (14)
basée sur la possibilité de reconnaître les cellules des
deux espèces grâce à des caractéristiques distinctives
révélées soit par la coloration de Feulgen-Rossenbeck
soit par l’utilisation d’anticorps monoclonaux (QCPN)
reconnaissant spécifiquement les noyaux des cellules
de la caille.
Bien que l’approche expérimentale des deux équipes
soit assez similaire, les résultats sont discordants (voir
tableau 1 et figure4). Ceci montre la difficulté d’in-
terprétation des manipulations expérimentales d’em-
Figure 4 : Vue de profil d’un crâne de poulet. Origine embryonnaire des
structures squelettiques de la charnière crânio-rachidienne selon Huang et
al. (8) A et Couly et al. (6) B.
Tableau 1 : Contributions embryonnaires aux différentes parties de la charnière crânio-rachidienne selon Couly et al. (6) et Huang et al. (8).
*Gérard Couly et al. (6) ont utilisé la nomenclature arcs antérieur et postérieur pour ventral et dorsal.
Arc antérieur * de l’atlas
Arc postérieur * de l’atlas
Portion céphalique de l’apophyse
odontoïde de l’axis
Portion caudale de l’apophyse
odontoïde de l’axis
Portion céphalique de l’axis
Exo-occipital
Basi-occipital
Supra-occipital
Condyles occipitaux
Couly et al. (6)
Somite 5
Somite 6
Somite 5
Somite 6
Somite 6
Somite 1
Somites 2, 3 et 4
Mésoderme céphalique
Somite 5
Huang et al. (8)
Somite 5 (partie crânienne)
Somite 6 (partie caudale)
Somite 5 (partie crânienne)
Somite 6 (partie caudale)
Somite 5
Somite 6
Somite 6
Somites 1, 2, 3, 4 et 5
Somites 1, 2, 3, 4 et 5
Somites 1 et 2
Somite 5
 6
6
 7
7
1
/
7
100%