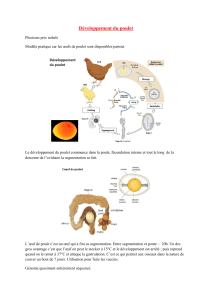
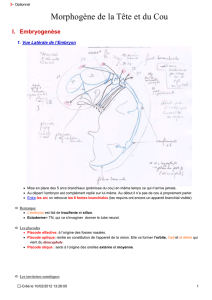
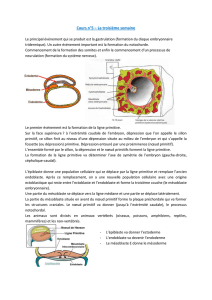
La segmentation du mésoderme chez les vertébrés - iPubli

médecine/sciences 1993 ; 9 : 791-9
!
.
?

()
9, 93

6·
8
o
.

°

s °
;
de
 6
6
 7
7
 8
8
 9
9
1
/
9
100%