Le 23/09/13 SOGHOMONIAN Astrid, L2 Tissu sanguin et

TISSU SANGUIN ET SYSTEME IMMUNITAIRE-PARTIE II-Principales étapes de l'hématopoïèse médullaire
Le 23/09/13
SOGHOMONIAN Astrid, L2
Tissu sanguin et système immunitaire
Pr Baccini
22 pages
PRINCIPALES ETAPES DE L'HEMATOPOIESE MEDULLAIRE
(lignées, maturation, voies de domiciliation tissulaire)
Partie II
A. Définition
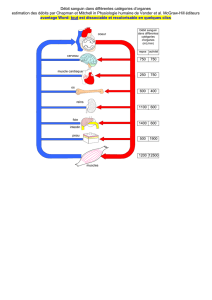
L’hématopoïèse représente l’ensemble des événements concourant à la fabrication et au remplacement continu
et régulé des cellules sanguines (production quotidienne de 10 11 à 10 12 cellules matures par jour).
Les cellules sanguines sont des cellules différenciées avec des marqueurs de lignée, sans pouvoir mitotique et
avec une durée de vie courte.
La production des cellules sanguines est permanente et très importante au niveau de la moelle osseuse
(exclusivement) du fait de l'absence de pouvoir mitotique chez ces cellules.
(La production est exprimée en giga/jour)
(Le prof a dit de bien connaître les durées de vie)
1/22
Plan
A. Définition
B. Les différents compartiments
I. Les cellules souches
II. Les progéniteurs
III. Les précurseurs
IV. Les cellules matures
C. Mécanismes moléculaires de la différenciation hématopoïétique
I. Rôle des facteurs de transcription
II. Rôle des facteurs de croissance
III. Récepteurs des facteurs de croissance
IV. Rôle du micro-environnement

TISSU SANGUIN ET SYSTEME IMMUNITAIRE-PARTIE II-Principales étapes de l'hématopoïèse médullaire
B. Les différents compartiments
Les cellules sanguines (hématies, polynucléaires, lymphocytes, monocytes et plaquettes) dérivent toutes d’une
même cellule indifférenciée : la cellule souche multipotente ou cellule souche primitive. La cellule souche est
capable de fournir tous les éléments figurés du sang.
Cette cellule, sous l’influence de différents facteurs, devient un progéniteur.
Le progéniteur est une cellule indifférenciée engagée dans une voie de différenciation et ayant un haut pouvoir
mitotique.
Les progéniteurs perdent peu à peu leur pouvoir mitotique et deviennent spécifiques d’une seule lignée : ce sont
des précurseurs morphologiquement identifiables (au myélogramme).
Les précurseurs se divisent puis acquièrent les marqueurs spécifiques de lignée : ce sont les cellules matures
qui passent dans le sang.
Les cellules matures exercent leur fonction au niveau sanguin. Ce sont, d'ailleurs, les seules situées dans le
compartiment sanguin, les autres cellule étant toutes dans la moelle osseuse.
2/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE-PARTIE II-Principales étapes de l'hématopoïèse médullaire
I. Les cellules souches
Les cellules souches (CSH) ont des capacités de :
•Autorenouvellement ce qui permet de maintenir le pool de CSH et ainsi d'assurer tout au long de la vie,
l'hématopoïèse sans aucune limite. Cette multiplication se fait sans aucune différenciation ; c'est un
autorenouvellement pur.
•Différenciation et multipotence Sous l'influence de facteurs de croissance sécrétés par les composants
du stroma suite à des stimuli (ces stimuli sont en relation avec les événements qui se produisent dans
l'organisme.ex : une hémorragie) la cellule souche se divise et s'engage dans une voie de différenciation
et puis vers une lignée.
En fonction du stimuli extérieur, la CSH est capable de donner tous les lignages myéloïdes et
lymphoïdes possibles : c'est la multipotence.
Par exemple : si elle est stimulée par l'EPO (érythropoïétine) elle s'engage vers la voie de différanciation
érythroblastique.
→ Expérience de Tille et Mc Culloh (1961) (mise en évidence des cellules souches) :
La souris est d'abord irradiée létalement. On lui injecte ensuite de la moelle osseuse et 8 jours après sa rate est
prélevée. Au niveau de la rate, sont visibles macroscopiquement, des points blancs (bleus sur le schéma) : ce
sont des nodules. Chaque nodule est composé des colonies de cellules, parfois mixtes (1 ou maximum 2
lignées) et strictement identiques.
Ces colonies reflètent l'injection de cellule souche dans la moelle irradiée, 8 jours auparavant. Une cellule
souche sous l'effet d'un grand nombre de facteurs de croissance a donné soit des colonies d'érythroblastes soit
de granuleux....
Ces colonies sont monoclonales et toutes identiques. Elle sont parfois mixtes car les progéniteurs peuvent être
engagés dans 2 voies de différenciation.
→ Chez l'homme :
-Une pathologie a permis de mettre en évidence l'aspect monoclonal. C'est la leucémie myéloïde chronique
(LMC) qui est caractérisée par une anomalie cytogénétique du chromosome Phi (translocation). Cette anomalie
est retrouvée chez les patients malades dans toutes les cellules hématopoïétiques mais pas dans les non
hématopoïétiques. Ce qui montre bien que cette maladie touche la cellule souche et que celle-ci est capable de
3/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE-PARTIE II-Principales étapes de l'hématopoïèse médullaire
donner tous les lignages hématopoïétiques.
-Il existe aussi une enzyme : la G6PD, présente dans le globule rouge. Chez les femmes hétérozygotes pour la
G6PD, atteintes de certaines pathologies hématologiques, on ne retrouve qu'un seul type de G6PD dans leurs
cellules malades.
-On a mis en place des tests de clonogénicité.
Les cellules souches sont donc :
•peu nombreuses (représentent à 0,01 à 0,1% de la moelle osseuse)
•invisibles (pas visibles sur le myélogramme)
•totipotentes, c'est-à-dire qu'elles sont capables de donner tous les lignages hématopoïétiques
•présentes essentiellement dans la moelle (avec toujours une très faible quantité dans le sang)
•possèdent divers marqueurs: CD34 est utilisé couramment en clinique
•leur congélation est possible à -196° (avec de l'azote liquide), tout en maintenant leurs caractéristiques
après décongélation.
•Elles sont bloquées en phase Go
→ Tests permettant de les mettre en évidence (tests de clonogénicité):
On dispose au fond d'une boîte de culture des cellules stromales médullaires, cellules adhérentes permettant
aux cellules hématopoïétiques de se développer dans une vraie moelle. Pendant 30 jours , on cultive ces cellules
en présence de facteurs hématopoïétiques et d'une moelle de patient.
Au bout de 30 jours, on repique ces cellules dans un milieu semi-gélosé avec des facteurs de croissance.
Au bout de 15 jours, on retrouve dans la boîte des nodules représentés exclusivement par des cellules
érythroïdes ou granuloïdes ou monocytaires.
(Si le facteur de croissance est l'EPO on retrouvera uniquement des érythroblastes dans les nodules.)
4/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE-PARTIE II-Principales étapes de l'hématopoïèse médullaire
Les cellules souches sont difficiles à mettre en évidence, on ne dispose que de ces tests de clonogénicité ou du
CD34 (en clinique).
II. Les progéniteurs
Ils correspondent au compartiment d'amplification.
Les progéniteurs ont un haut pouvoir mitotique et sont déjà engagés dans une voie de différenciation : le retour
est donc impossible, la cellule est déjà programmée vers 1 ou 2 lignages maximum : soit érythroblastique ; soit
mégacaryocytaire ; soit granulo-monocytaire ; soit eosinophile ; soit basophile.
Leur autorenouvellement est quasiment nul, tandis que leur index prolifératif est très élevé (pour augmenter le
pool cellulaire).
→ Mise en évidence : Cultures de progéniteurs
5/22
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%