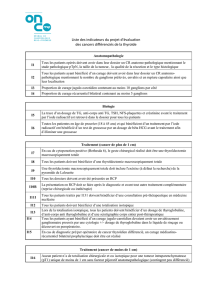
Le point actuel sur la thyroglobuline.

A. Charrié
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2003 - vol.27 - n°4 177
Résumé
La thyroglobuline, protéine précurseur de la synthèse des hormones thyroïdiennes est
détectable au niveau sérique. Son dosage est un vrai challenge. Les techniques actuelles, pour la
plupart immunométriques, n’ont pas toutes les qualités requises, ce qui rend difficile l’interpréta-
tion des résultats de thyroglobuline. Il existe une grande variabilité interlaboratoires en partie liée
à l’absence de standard international, mais aussi à la grande hétérogénéité de la molécule de
thyroglobuline ce qui retentit sur son immunoréactivité. La limite de détection, la reproductibilité
interséries, la possibilité d’un effet crochet sont d’autres caractéristiques à tester. Le problème
majeur reste l’interférence due aux autoanticorps antithyroglobuline. Ils induisent une sous-
estimation des concentrations de thyroglobuline par ces méthodes immunométriques. Aucune
méthode actuelle de dosage n’est totalement exempte de cette interférence. Il est donc recom-
mandé de doser systématiquement les anticorps antithyroglobuline, en parallèle du dosage de
thyroglobuline, à l’aide d’une méthode sensible. Les tests de récupération doivent être éliminés.
L’interprétation des résultats de dosage de thyroglobuline doit tenir compte de l’état thyroïdien du
sujet, de la masse de tissu thyroïdien et de la stimulation du récepteur à TSH.
Thyroglobuline sérique / Dosage / Interférence / Anticorps antithyroglobuline / Caractéristiques techniques
Correspondance : Anne Charrié - Laboratoire de Techniques Nucléaires et Biophysiques - Centre Hospitalier Lyon Sud
69495 Pierre-Bénite Cedex
Tel. : 04 78 86 21 50 - Fax : 04 78 86 32 63 - E-mail : anne.charrie@chu-lyon.fr
Le point actuel sur la thyroglobuline.
Anne Charrié Laboratoire de Techniques Nucléaires et Biophysiques
Centre Hospitalier Lyon Sud - Pierre-Bénite
STRUCTURE
ðGlycoprotéine de haut poids mo-
léculaire (660 kDa) et de coefficient
de sédimentation 19S, la thyroglobu-
line est constituée de 2 sous-unités
identiques liées par des ponts disul-
fures et de 2 750 acides aminés cha-
cune. Les 2 chaînes polypeptidiques
sont identiques au moment de leur
synthèse puis subissent des modifi-
cations du type glycosylations, phos-
phorylations, iodations.
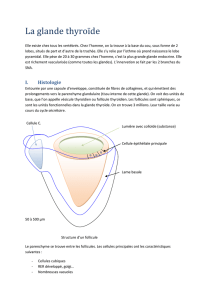
La thyroglobuline (Tg) est stockée
dans la lumière folliculaire où elle
constitue 90 % des protéines de la
colloïde. Elle contient de l’iode sur
les résidus tyrosyls. Les sites d’ioda-
tions les plus précoces sont situés en
5 points bien précis (Figure 1Figure 1
Figure 1Figure 1
Figure 1). Il est
à noter que 44 % de la synthèse de T4
et 25 % de la synthèse de T3 sont réa-
lisés au niveau du site Tyr5 (extrémité
N terminale). Plusieurs espèces de Tg
sont connues aujourd’hui, en parti-
culier la Tg humaine et la Tg porcine
qui ont 77 % d’homologie.

Le point actuel sur la thyroglobuline
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2003 - vol.27 - n°4
178
Figure 1 - Représentation schématique du monomère de hTgFigure 1 - Représentation schématique du monomère de hTg
Figure 1 - Représentation schématique du monomère de hTgFigure 1 - Représentation schématique du monomère de hTg
Figure 1 - Représentation schématique du monomère de hTg
D’après D’après
D’après D’après
D’après
YY
YY
Y..
..
. Malthiér Malthiér
Malthiér Malthiér
Malthiéry [1]y [1]
y [1]y [1]
y [1]
ANTIGÈNE THYROÏDIEN
ðLa Tg est une protéine fortement an-
tigénique. C’est le principal auto-an-
tigène thyroïdien ; la fréquence des
auto-anticorps anti-Tg est importante.
La molécule exprime au moins 40
déterminants antigéniques ; une dou-
zaine d’épitopes est bien identifiée,
6 ou 7 sont constants [1].
Les techniques classiques de l’immu-
nologie (inhibition de liaison, réacti-
vité croisée) ont permis de détermi-
ner une carte épitopique de la molé-
cule. La région centrale est majoritai-
rement immunoréactive (Figure 1Figure 1
Figure 1Figure 1
Figure 1).
DOSAGE DE LA THYROGLOBULINE
ðA l’heure actuelle, il existe une
quinzaine de trousses sur le marché.
Elles sont de caractéristiques différen-
tes et de qualités variables. A l’excep-
tion de quelques rares trousses de
dosage RIA, le marché international
est constitué essentiellement de
trousses de type sandwich avec mar-
queurs radioactifs, chimilumi-
nescents et fluorescents.
Malgré l’amélioration des méthodes
due à l’utilisation des anticorps mo-
noclonaux, il existe une grande dis-
persion des résultats.
PROBLÈMES ANALYTIQUES
ðIls peuvent être classés en 5 items :
- différences de standardisation,
- sensibilité des techniques,
- reproductibilité interséries,
- présence de l’effet crochet,
- interférence par les auto-anticorps.
Standardisation
ðElle pose à l’heure actuelle encore
des problèmes qui peuvent en partie
expliquer les différences de résultats
notées sur les contrôles Probioqual
(Figure 2Figure 2
Figure 2Figure 2
Figure 2).
Les standards utilisés dans les diffé-
rentes trousses de dosage sont ex-
traits de tissu thyroïdien normal ou
pathologique. Selon les procédés de
fabrication, on peut s’attendre à une
certaine variabilité de composition en
iode, en sucres, en aminoacides en-
tre les Tg des standards.
Un standard européen a été déve-
loppé (CRM 457) ; disponible, il n’est
pas encore utilisé dans les trousses
de dosage de Tg [2]. Son utilisation
pourrait diminuer - selon les études -
de 40 à 20 % la variabilité des résul-
tats de Tg d’une trousse à une autre.
Ce standard recommandé ne résout
cependant que partiellement les pro-
blèmes.
- Figure 2 -- Figure 2 -
- Figure 2 -- Figure 2 -
- Figure 2 -
Enquête Probioqual Décembre 2002Enquête Probioqual Décembre 2002
Enquête Probioqual Décembre 2002Enquête Probioqual Décembre 2002
Enquête Probioqual Décembre 2002

A. Charrié
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2003 - vol.27 - n°4 179
Le standard idéal serait une prépara-
tion extraite du sang et non du tissu
thyroïdien comme c’est le cas actuel-
lement. La forme circulante de la Tg
est pratiquement exclusivement la
forme dimérique produite par la thy-
roïde, de 660 kDa et de coefficient de
sédimentation 19S. Druetta et coll. [3]
ont montré qu’il n’y avait pas de
molécules de masse différente pré-
sente au niveau sanguin : la disper-
sion des enquêtes interlaboratoires
pourraient être dues à des différen-
ces de motifs antigéniques reconnus
sur la Tg : il existe une immuno-réac-
tivité différente entre la Tg tissulaire
et la Tg sanguine. Ces différences
d’immunoréactivité seraient la con-
séquence du processus de sécrétion
de la Tg circulante. Trois hypothèses
de sécrétion ont été évoqués (FigureFigure
FigureFigure
Figure
33
33
3) [3]. Dans le cas d’une thyroïde
normale ou stimulée (maladie de
Basedow), la thyroglobuline forte-
ment iodée située dans l’espace fol-
liculaire clos réintègre le milieu
intracellulaire afin de libérer les hor-
mones thyroïdiennes dans la circula-
tion sanguine (par 2 mécanismes dé-
crits : la macropinocytose et la micro-
pinocytose). Il existe un transport
apico-basolatéral de Tg ou transcytose
de petites quantités variables de Tg
qui explique la présence physiologi-
que de Tg dans le sérum. Dans le cas
de la thyroïdite subaigüe, après rup-
ture de certains follicules, il y a appa-
rition de Tg dans la circulation direc-
tement sans passer par la cellule. Cette
Tg est identique à la Tg de la thyroïde.
Dans le troisième cas, il existe une
perturbation de l’organisation cellu-
laire (cancer) et la sécrétion de Tg est
directe, sans stockage. Les molécules
de Tg sont peu ou pas iodées. Dans
le cas du cancer, il existe une hétéro-
généité en iode et en résidus glyco-
sylés qui ont des effets sur la confor-
mation de la molécule. Les anticorps
du dosage sont dirigés contre des
épitopes conformationnels. Ceci peut
expliquer que cette hétérogénéité
produise des réponses différentes
suivants les anticorps employés.
- Figure 3 -- Figure 3 -
- Figure 3 -- Figure 3 -
- Figure 3 -
Schéma hypothétique de la sécrétion de la thyroglobuline selon la situation de la thyroïdeSchéma hypothétique de la sécrétion de la thyroglobuline selon la situation de la thyroïde
Schéma hypothétique de la sécrétion de la thyroglobuline selon la situation de la thyroïdeSchéma hypothétique de la sécrétion de la thyroglobuline selon la situation de la thyroïde
Schéma hypothétique de la sécrétion de la thyroglobuline selon la situation de la thyroïde
(D’après L. Druetta)(D’après L. Druetta)
(D’après L. Druetta)(D’après L. Druetta)
(D’après L. Druetta)
Limite de détection
ðCe paramètre a une importance ca-
pitale pour :
- mieux déceler les résidus thyroï-
diens post thyroïdectomie totale,
- déceler le plus précocement les ré-
sidus de cancer thyroïdien même
pour des patients sous freinage thy-
réotrope,
- déceler lors de l’administration de
TSH recombinante une augmentation
de Tg, signe de résidu ou de récidive.
La limite de détection analytique in-
diquée par les fournisseurs de trous-
ses n’est pas utilisable pour le suivi
des patients. Il faut utiliser la limite
de détection fonctionnelle définie
comme étant la plus faible concen-
tration pouvant être mesurée de fa-
çon répétitive en reproductibilité
interessais avec un coefficient de va-
riation de 20 %. Elle doit être définie
pour chaque trousse et étudiée sur
une durée suffisamment longue :13
séries minimum espacées sur 6 à 12
mois selon les critères de C. Spen-
cer [4].
Mais les valeurs de cette limite de
détection fonctionnelle ne sont pas
comparables d’une trousse à une
autre si le standard de référence n’est
pas le même.
Pour la trousse de dosage actuelle
Schering Cis Biointernational (trousse
développée initialement par Sanofi
Pasteur [5]), la limite de détection
fonctionnelle déterminée avec les
critères de C. Spencer est de 1µg/L
(Figure 4Figure 4
Figure 4Figure 4
Figure 4) [6].

Le point actuel sur la thyroglobuline
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2003 - vol.27 - n°4
180
- Figure 4 -- Figure 4 -
- Figure 4 -- Figure 4 -
- Figure 4 -
Détermination de la sensibilité fonctionnelle grâce au profil de précision.Détermination de la sensibilité fonctionnelle grâce au profil de précision.
Détermination de la sensibilité fonctionnelle grâce au profil de précision.Détermination de la sensibilité fonctionnelle grâce au profil de précision.
Détermination de la sensibilité fonctionnelle grâce au profil de précision.
(D’après P(D’après P
(D’après P(D’après P
(D’après P
..
..
. Flor Flor
Flor Flor
Flori)i)
i)i)
i)
Reproductibilité interséries
ðLe dosage de Tg lors du suivi des
cancers thyroïdiens différenciés est
généralement annuel ce qui justifie
une bonne reproductibilité d’une
année sur l’autre. Une mauvaise re-
productibilité pourrait différer la dé-
tection de rechute de progression de
la maladie.
Les coefficients de variations en
interséries interlaboratoire sont infé-
rieurs à 15 % (Probioqual) si l’on s’in-
téresse à des valeurs supérieures à 5
µg/L. Pour des valeurs inférieures à 5
µg/L, les coefficients de variation aug-
mentent plus on se rapproche de la
sensibilité fonctionnelle pour attein-
dre alors 20 %. Cette constatation a
amené la réflexion suivante : substi-
tuer une reproductibilité intrasérie
toujours meilleure à la reproductibi-
lité interséries (C. Spencer).
Ceci implique de conserver les sé-
rums des patients à –20° C pour pou-
voir les doser ultérieurement lors-
qu’un nouveau prélèvement est réa-
lisé de manière à effectuer les deux
dosages dans la même série.
Effet crochet
ðCe phénomène existe comme dans
beaucoup de techniques immuno-
métriques sandwich lorsque les do-
maines de concentration sont très
importants. L’effet crochet abaisse
faussement le résultat des dosages.
Dans certaines techniques en 1 étape,
l’effet crochet existe à partir de 300
µg/L.
Comment y remédier ?
- soit faire une dilution systématique
lors du dosage, ce qui augmente
significativement le coût du dosage.
- soit utiliser une technique en 2 éta-
pes (avec incubation séquentielle des
réactifs et lavage) qui affranchit alors
du phénomène.
La fréquence des résultats de thyro-
globuline très élevés est rare (de l’or-
dre de 3 à 4 % pour des valeurs supé-
rieures à 500 µg/L), mais existe.
Interférence par les auto-anticorps
ðCe problème d’interférence dans
les dosages de thyroglobuline est ma-
jeur, et non résolu à l’heure actuelle.
La prévalence des auto-anticorps anti-
thyroglobuline est variable selon les
études : de 15 à 45 %, en particulier
chez des patients atteints de cancers
différenciés de la thyroïde. Cette va-
riabilité dépend des méthodes de
détection. La variabilité d’affinité, la
quantité d’anticorps, la durée néces-
saire pour que l’équilibre réactionnel
antigène-anticorps soit atteint font que
chaque méthodologie détecte une
certaine catégorie de molécules. Tech-
niquement, les auto-anticorps interfè-
rent dans les méthodes sandwich soit
en empêchant la thyroglobuline de
se fixer aux anticorps de la phase
solide, soit en inhibant la liaison du
deuxième anticorps : l’anticorps mar-
qué. Dans tous les cas la valeur de
thyroglobuline est faussement abais-
sée.
Comment prendre en compte ces
anticorps antithyroglobuline ?
Pour détecter le sens et l’importance
de cette interaction, un test de récu-
pération ou test de surcharge est pro-
posé dans certaines techniques. Il est
réalisé en additionnant de la thyro-

A. Charrié
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2003 - vol.27 - n°4 181
globuline étalon à un échantillon de
sérum et en calculant le pourcentage
de thyroglobuline retrouvé. L’inter-
prétation du test est très délicate :
- le pourcentage de récupération ad-
mis comme acceptable fluctue en
fonction des études et est compris
dans la fourchette de 70 à 130 % de la
quantité ajoutée. Le problème est que
ce pourcentage varie suivant les étu-
des et semble important,
- la quantité préconisée de thyroglo-
buline utilisée pour la surcharge n’est
pas définie,
- la thyroglobuline utilisée pour sur-
charger est différente de la thyroglo-
buline à doser donc les auto-anticorps
peuvent se lier à des épitopes diffé-
rents de ceux de la thyroglobuline
du sérum,
- le temps d’incubation n’est pas suf-
fisant pour que l’équilibre d’associa-
tion antigène-anticorps soit atteint,
- il n’existe pas de corrélation entre
le titre des anticorps anti-thyroglobu-
line et un mauvais test de récupéra-
tion.
En conclusion, le test de récupéra-
tion tel qu’il est pratiqué à l’heure
actuelle ne peut servir de critère de
validation du dosage de thyroglobu-
line [7]. Il est actuellement décon-
seillé. En revanche, il est nécessaire
de doser les anticorps anti-thyroglo-
buline par une méthode suffisam-
ment sensible (les méthodes par
hémagglutination sont à proscrire)
systématiquement lors du dosage de
la thyroglobuline.
INTERPRÉTATION DU DOSAGE
DE THYROGLOBULINE
Valeurs de référence
ðEtablies dans une population de su-
jets euthyroïdiens indemnes de toute
pathologie thyroïdienne n’ayant pas
d’anticorps anti-thyroïdiens, non fu-
meurs, elles vont de 3 à 40 µg/L. La
thyroglobuline est plus élevée chez
la femme enceinte. La palpation du
cou n’entraîne pas d’augmentation de
la thyroglobuline ; en revanche la
ponction à l’aiguille fine augmente les
valeurs de thyroglobuline.
La demie-vie de la thyroglobuline
sérique est de 2.7 jours.
Interprétation en fonction
de la pathologie
ðLe dosage de thyroglobuline est uti-
lisé pour le suivi des cancers diffé-
renciés de la thyroïde. La thyroglobu-
line n’est pas un élément diagnostic
de cancer puisqu’elle signe la pré-
sence de tissu thyroïdien qu’il soit
sain ou pathologique. Son interpréta-
tion doit tenir compte du statut
thyroïdien du sujet [8] :
- thyroïdectomie totale suivie d’une
totalisation isotopique : dans ce cas
la thyroglobuline doit être indosable,
- chirurgie thyroïdienne partielle (lo-
bectomie, loboisthmectomie) : on
surveille l’évolution de la thyroglo-
buline dosable.
Simultanément, les anticorps anti-thy-
roglobuline sont dosés. Après thyroï-
dectomie totale, les auto-anticorps se
négativent dans les mois ou années
qui suivent, pour ceux qui ne présen-
tent pas de récidives. La présence ou
l’augmentation d’auto-anticorps anti-
thyroglobuline à distance (plusieurs
années) reste un facteur de mauvais
pronostic et parfois le signe d’une
récidive.
Current status of thyroglobulin
Thyroglobulin, the precusor protein for thyroid synthesis is detectable in the serum. Its
assay is a real challenge. Current methods, most of them immunometric, don’t present all the
required qualities to enable a proper interpretation of thyroglobulin results. A great interlaboratory
variability exists party due to an absence of worldwide standardisation but also to an important
heterogeneity of the thyroglobulin molecule which has an incidence on its immunoreactivity.
Detection limit, between run precision, and a hook effect possibility are other characteristics which
have to be tested. The major problem lies in the interference due to thyroglobulin autoantibodies .
They lead to an underestimation of thyroglobulin concentrations through these immunometric
methods. No current thyroglobulin method is garanteed free from this interference. It is
recommanded to systematically assess autoantibodies at the same time as evaluating thyroglobulin
by a sensitive method. Recovery tests should be eliminated. Thyroglobulin interpretation should
take into account the thyroid status of the patient, the thyroid mass and the TSH receptor stimula-
tion.
Serum thyroglobulin / Assay / Interference / Autoantibodies / Performance characteristics
 6
6
1
/
6
100%