TD2GLYCOLYSE2013 - Faculté des Sciences Oujda

UNIVERSITE MOHAMMED I
Faculté des sciences
Département de biologie
Année universitaire 2012/2013
Biochimie métabolique
Pr. SAALAOUI Ennouamane
TD N°2 Glycolyse
Exercice N°1:
Les variations des énergies libres standards (en Kcal/mole) des dix réactions de la
glycolyse pour la conversion du glucose en pyruvate sont les suivantes :
N° Réaction
1
2
3
4
5
6
7
8
9
10
∆G°’
-4
+0.4
-3.4
+5.73
+1.83
+1.5
-4.5
+1.06
+0.44
-7.5
1/Interpréter ces valeurs de ∆G°’
2/Donner la réaction globale de la conversion du glucose en pyruvate
3/Monter que la glycolyse est une voie à sens unique et irréversible
Exercice N°2:
La concentration de fructose-6P est régulée principalement par l’action de la phosphofructokinase-1
(PFK-1) et de la fructose 1,6 bisphosphatase (FBPase), par les réactions suivantes :
L’effet du Fructose 2,6 bisphosphate est testé sur l’activité de ces deux enzymes
a. Interpréter les résultats obtenus. Que pouvez-vous en conclure ?
b. Quelles sont les autres constituants moléculaires pouvant intervenir dans la régulation de
l’activité de ces 2 enzymes ?
c. Quelle est la régulation de la synthèse du Fructose 1,6 bisphosphate dans le foie ?
d. Indiquer la signification métabolique de chacun des ligands allostériques de la PhosphoFructoKinase 1.

Exercice N°3
Les concentrations de lactate dans le plasma sanguin avant, pendant, et après un sprint de 400 m sont
représentées sur le graphe ci-contre :
a. Pourquoi existe-t-il une augmentation rapide de la concentration de lactate dans le sang ? Quelle
est son origine ?
b. Quelle est la cause de la chute de la concentration de lactate après la fin de la course ? Que devient-il ?
c. Pourquoi la concentration de lactate sanguin n’est-elle pas nulle en dehors des périodes d’exercice
musculaire intense ?
Exercice N°4 : CATABOLISME DU LACTOSE ET DU SACCHAROSE EN AEROBIOSE
Le lactose (ß-D-galactopyranosyl 1→.4 D-glucopyranose) est d’abord hydrolysé en glucose et en
galactose. Le saccharose (α-D-glucopyranose1→2 ß-D-fructofuranoside.) est d’abord hydrolysé en glucose et
en fructose. Ces oses empruntent ensuite la voie de la glycolyse selon le schéma ci-dessous :
1. Comparer les bilans énergétiques de la dégradation d’une mole de lactose et d’une mole de saccharose en
aérobie, en supposant que les oses libérés à partir de ces diholosides empruntent immédiatement la voie de la
glycolyse.
2 Lors d’un petit déjeuner comportant du lait et de la confiture il est ingéré entre autres 10 g de lactose et 30g
de saccharose. Calculer le nombre de mole d’ATP formées en supposant que les oses libérés à partir de ces
diholosides empruntent immédiatement la voie de la glycolyse.
MM lactose = MM saccharose = 342 g.mol-1

Solution du TD:
Exercice N°1
1/Il y a 4 réactions à ∆G°’ négatif donc c’est irréversibles et toutes les autres travaillent
près de l’équilibre si ce n’est pas des réactions endergoniques qui exigent de l’énergie.
NB : La réaction N°7 a un ∆G qui est égal à +0.3 tandis que les réactions 1. 3 et 10 ont
vraiment des ∆G qui sont négatives ((-8 , -5.3 et -4)
La réaction N° 4 a un ∆G°’ de +5.7 et elle a lieu car le G3P est utilisé par les autres
réactions qui suivent 6.7.8….)
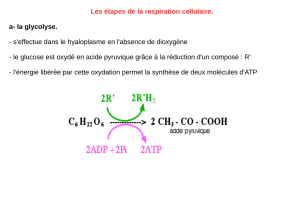
2/ Glucose + 2 Pi + 2ADP 2 pyruvates+ 2 NADH + 2 H++ 2 H2O
3/Comme au TD N°1, les ∆G°’ total de la conversion du glucose en pyruvate est égal
à ∑∆G°’ Rn = -8.44 Kcal/mole. Ce qui correspond à un K de 106 à 298°K
∆G°’ = -2.33.RTlog10Keq
log10Keq= -8.44*1000/-2.33*1.987*298 = 6.11
Donc K est supérieure à 106 , est en faveur de la production du pyruvate
Exercice N°4
a. Une mole de lactose libère une mole de galactose et une mole de glucose
Une mole de glucose permet la synthèse de 38 moles d’ATP (cf. cours), une mole de
galactose permet la synthèse de 37 moles d’ATP (une mole d’ATP supplémentaire est
utilisée lors de la conversion du galactose-1P en Glucose –1P), soit au total 75 moles d’ATP
Une mole de saccharose libère une mole de fructose et une mole de glucose
Une mole de fructose permet également la synthèse de 38 moles d’ATP soit au total 76
moles d’ATP
b. 10 g de lactose et 30 g de saccharose correspondent respectivement à 10/342 =
0,0292 mole de lactose et 30/342 = 0,0877 mole de saccharose, il y a donc libération
de :
- 0,0292 + 0,0877 = 0,070 mole de glucose qui permettent la synthèse de 0,070 x 38 = 4,44
moles d’ATP
- 0,0292 mole de galactose qui permettent la synthèse de 0,0292 x 37 = 1,08 moles d’ATP
- 0,0877 mole de fructose qui permettent la synthèse de 0,0877 x 38 = 3,33 moles d’ATP
Soit au total 8,85 moles d’ATP
Exercice N°2 :
a. Interpréter les résultats obtenus :
Les deux réactions qui sont citées correspondent à la troisième étape de la glycolyse dans le sens
de la phosphorylation ainsi que la déphosphorylation impliquée dans la glucogenèse
Cette étape est importante dans la glycolyse (∆G = -5.3 et ∆G°’=-3.4 Kcal/mole) et a un rôle
régulateur surtout qu’elle fait partie des 3 réactions exergoniques de la glycolyse (1, 3 et 10) ; le flux
métabolique ainsi que les composants moléculaires peuvent les contrôler selon les besoins cellulaires.

L'accumulation de Fru-1,6-diP signifie qu'il n'est pas consommé par les étapes en aval de la voie, et que donc le
besoin en énergie est moindre, qu'il faut donc en quelque sorte ralentir la glycolyse.
Les deux enzymes (PFK1 et F1.6BPase) ne présentent pas de comportement mickaelin (càd une
hyperbole) mais ce sont des enzymes à régulation allostérique d’après leurs allures. La PFK a l’allure
(sigmoïde) d’une enzyme à coopérativité positive (càd plus vous augmenter la [S] plus l’affinité
s’améliore) tandis que la F1.6BPase a l’allure d’une coopérativité négative vis-à-vis de son substrat.
Le F1,6 diP est substrat pour l’une et produit pour l’autre, Le F2,6 biP est un activateur de la
PFK1 et un inhibiteur de la FBPase. Le F2,6 biP lui-même est synthétisé par la PFK2 et ils est
converti en F6P par la F2.6BPase
Que pouvez-vous en conclure ? Un bon exemple d’étude de l’allostérie
Le F2,6 biP est un activateur pour la première activité (diminution du Km) et c’est inhibiteur pour
la seconde activité (augmentation du Km). Le F2.6biP active la PFK1 et inhibe la F1.6diPase
lançant ainsi la glycolyse et freinant la gluconéogenèse. Les remarques constatées ici sont
l’inverse de ce qui s’observe pour la PFK2 et la F2.6BPase.
b. Quelles sont les autres constituants moléculaires pouvant intervenir dans la régulation de
l’activité de ces 2 enzymes ? voir cour, entre autre le glucagon , l’AMPc
c. Quelle est la régulation de la synthèse du Fructose 2,6 bisphosphate dans le foie ?
d. Indiquer la signification métabolique de chacun des ligands allostériques de la PhosphoFructoKinase 1.
Exercice 3 :
Le cycle de CORI
Au cours d’un exercice violent, la vitesse de production du pyruvate par la
glycolyse excède la vitesse d’oxydation du pyruvate par le cycle de l’acide citrique.
La vitesse de formation du NADH est plus grande que la vitesse de son oxydation
par la chaîne respiratoire. L’accumulation du NADH et du pyruvate va former du
lactate. Le lactate gagne du temps et déplace une partie de la charge métabolique du
muscle vers le foie. En effet le sang va transporter le lactate jusqu’au foie qui est
oxydé en pyruvate qui par la néoglucogenèse va former du glucose libéré dans le
sang afin d’alimenter les muscles.
Dans le début de l’effort musculaire, la glycolyse cytoplasmique (GC)
anaérobie, utilise rapidement le glucose, produit deux liaisons riches en énergie par
glucose oxydé et libère du pyruvate. Le pyruvate est réduit en lactate par l’excédent
de NADH ou transaminé en alanine lorsque le muscle (à jeun) catabolise des acides
aminés.
Le lactate est transporté par le sang vers le foie dont le métabolisme
fonctionne toujours en aérobiose. Le foie peut alimenter son métabolisme

énergétique uniquement grâce à la β-oxydation en produisant des corps cétoniques.
Dans ces conditions, il peut faire sortir le malate hors de la mitochondrie et
resynthétiser du glucose par la gluconéogénèse (GNG). Le lactate absorbé par le
foie est un substrat de cette gluconéogénèse qui consomme six liaisons riches en
énergie par glucose produit. Le foie libère le glucose dans la circulation qui peut à
nouveau être oxydé par les muscles.
L’association de la glycolyse anaérobie des muscles et de la gluconéogénèse
du foie constitue le cycle des CORI (deux biochimistes C. et G. CORI).
Elimination du lactate
L'élimination du lactate est assurée par plusieurs mécanismes :
par sa transformation en glucose ou en glycogène (néoglucogenèse). 15 à 20% de la quantité totale du lactate est
ainsi transformée en glycogène surtout au niveau du foie par le cycle de Cori.
par oxydation en pyruvate : cette oxydation est la réaction inverse de celle donnant naissance au lactate. Elle est
catalysée par l'isoenzyme LDH H. Elle se fait essentiellement au niveau des muscles et du myocarde. Elle
représenterait pour ces deux structures une source importante d'énergie (Freund et Zouloumian 1987, Freund et al
1986, Brooks 1987)
le reste est excrété principalement par le rein, accessoirement par la sueur.
A travers les mécanismes mis en jeu pour éliminer le lactate nous pouvons nous rendre compte que ce dernier
contribue à la fourniture d'énergie via la formation de nouvelles molécules de glucose et via sa dégradation en
présence d'oxygène. Nous touchons là au rôle énergétique que ce dernier peut jouer. Mais nous reviendrons sur ce
point. Continuons à envisager l'apparition et l'enlèvement du lactate dans le sang.
A tout moment, la masse totale de lactate dans le sang traduit la combinaison des deux processus que nous venons
d'envisager : son apparition (production musculaire et transfert) et sa disparition (métabolisation et excrétion).
1
/
5
100%