- enseignement Catholique

1
Document1
AUTEUR : Philippe Schweich
Fiche d’expérience 3
Cette expérience peut être réalisée par les élèves moyennant le respect des mesures préconisées
dans l’analyse de risques. Les points 2 à 5 de cette fiche seront alors mis à leur disposition.
Observer les chromosomes présents dans les cellules
d’oignon
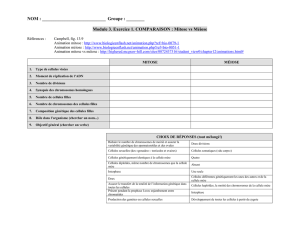
1. Description générale
Le noyau est visible dans la plupart des cellules. Il contient les chromosomes qui ont alors l’aspect de
filaments très enchevêtrés constituant la chromatine.
Cependant, lorsqu’une cellule entre en division au cours d’un phénomène appelé mitose, le noyau
disparait et les chromosomes se condensent pour prendre la forme de petits bâtonnets.
Pour observer les noyaux de cellules ainsi que les chromosomes au cours de mitoses, on utilise la
coloration de Feulgen. Celle-ci donne une couleur rouge spécifique à l'ADN. On peut alors observer des
noyaux en interphase (la chromatine est colorée mais pas les nucléoles) ainsi que différents moments
de la mitose au cours desquels les chromosomes sont bien individualisés (comme par exemple durant
la métaphase).
2. Objectifs d’apprentissage
Identifier différentes étapes du cycle cellulaire. L’élève apprend à reconnaitre dans un tissu une cellule
en interphase et une cellule en cours de division (ou en mitose). De plus, l’observation de différentes
cellules en mitose permettra d’identifier quelques moments importants de la division : la prophase, la
métaphase, l’anaphase et la télophase.
3. Matériel et produits
- Une lame porte-objet
- Une lamelle couvre-objet
- Un oignon mis en germination
- De l’acide chlorhydrique 1 mol/L
- Du réactif de Schiff
- Une solution aqueuse de Na2S2O5 à 5 % acidifiée par quelques
gouttes d'HCl 1mol/L (facultatif)
- De l’eau de la distribution
- Un bain-marie à 60°C
HGT - SCB
Biologie
UAA3

2
Document1
4. Santé, sécurité
La réalisation d’expériences suppose le respect d’un certain nombre de règles permettant à chacun,
élèves et professeur, de vivre ces séances de laboratoire dans les meilleures conditions de sécurité.
Pour chaque local où se déroulent de telles expériences, existe un règlement de laboratoire,
approuvé par le Conseiller en Prévention. Il sera signé par le chef d’établissement, le professeur,
l’élève et ses parents/responsables.
Chaque élève a une bonne connaissance de ce document.
Analyse de risques
Phases
Points-clés
Sources de danger
Nature du risque
Mesures de prévention
préconisées
Avant
(Professeur)
Organisation de la
classe
Les déplacements des élèves
Afin de limiter les déplacements,
installer des postes de travail avec tout
le matériel nécessaire pour le groupe.
Pendant
(Professeur et
élèves)
Chauffage de HCl 1M
à 60°C pendant 12
min
Attention l’acide chlorhydrique
est un produit corrosif : utiliser
un bain thermostatisé à 60°C
La manipulation se déroulera sous
hotte.
Rinçage des apex
dans une solution de
Na2S2O5
Les vapeurs dégagées sont du
SO2, un gaz irritant.
La manipulation se déroulera sous
hotte.
La préparation
microscopique se
brise suite à une
manipulation
Risque de coupure
Les lames brisées au cours de la
manipulation doivent être placées, par
le professeur, dans un contenant prévu
pour la récupération du verre cassé.
Après
(Professeur et
élèves)
Nettoyage et
rangement des lames
Nettoyage du matériel et des
mains de manière hygiénique
Les lamelles couvre-objet peuvent être
jetées à la poubelle, tandis que les
lames porte-objet seront nettoyées
minutieusement avec du savon
désinfectant.
Coupures si de la verrerie est
cassée
Les élèves appellent le professeur qui
se charge lui-même de ramasser les
débris.
Nettoyage des mains
Professeur et élèves se lavent les
mains en fin de séance.

3
Document1
5. Mode opératoire
a) Mettre en germination 4 à 5 jours avant la séance, des petits oignons (voir photo ci-dessus).
b) Couper les racines à 1 cm de la pointe lorsqu’elles ont atteint la longueur de 1,5 cm.
c) Mettre ces pointes de racine (appelées apex) dans HCl 1 mol/L à 60°C pendant 12 minutes.
d) Rincer les apex dans l'eau de distribution.
e) Placer les apex dans du réactif de Schiff pendant minimum 15 minutes.
f) Récupérer les apex, rincer dans de l'eau puis (facultatif) dans une solution de Na2S2O5 à 5 %.
g) Déposer les apex sur une lame porte-
objet et réaliser le montage dans une
goutte d'eau.
h) Presser la lamelle couvre-objet pour écraser la préparation afin de disperser les cellules.
i) Observer d'abord à faible grossissement (voir fiche FM1), sélectionner une cellule en division
puis passer au grossissement x 400 pour observer les noyaux et les figures de mitose.
j) Réaliser un dessin d’observation (voir fiche FM2).
6. Notes pour le professeur
a) Au cours de sa vie, une cellule grandit puis se divise pour donner deux cellules filles qui lui sont
identiques. On désigne sous le terme de cycle cellulaire les différentes étapes par lesquelles passe
une cellule vivante entre deux divisions successives. Un cycle cellulaire comporte deux étapes :
l'interphase et la mitose.
b) La coloration de Feulgen a été mise au point en 1924 par le chimiste allemand Robert Feulgen
(1884-1955). Elle permet la mise en évidence des chromosomes et leur observation au microscope
photonique.
Dans un premier temps, une hydrolyse acide libère une forme aldéhydique du désoxyribose, qui est
décelée par le réactif de Schiff (fuchsine basique décolorée par le SO2).
Le squelette de l'ADN n'est pas modifié, il reste en place et il est coloré en rose rouge.
Le rinçage dans une solution de Na2S2O5 à 5 % est facultatif mais cette étape permet d’éviter
certaines colorations parasites.

4
Document1
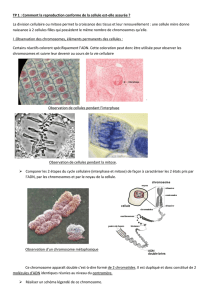
c) Les observations réalisées par les élèves seront les suivantes
À faible grossissement, repérer les cellules en division.
Passer ensuite au grossissement X400 pour observer les différentes moments de la mitose.
Cellules de racine d’oignon (X400)
7. Développements attendus principalement visés
Décrire les phases du cycle cellulaire et expliquer le rôle de la mitose (C8).
L'élève décrit comment l’ADN est transmis afin de maintenir la même information génétique dans
toutes les cellules somatiques.
L'élève explique que la multiplication cellulaire est un phénomène indispensable au développement
d’un organisme (augmenter le nombre de cellules et les renouveler).
Identifier les chromosomes au cours de la mitose sur des images de coupe de microscope optique
(A2).
L’élève repère les différentes apparences que peut prendre l’intérieur du noyau d’une cellule et
identifie les différents aspects de la chromatine et des chromosomes.
8. Bibliographie
Vidéo montrant comment colorer les noyaux d’une cellule par la méthode de Feulgen, avec le réactif de
Schiff. Durée : 117 s
http://www.svt.ac-versailles.fr/spip.php?article459 (page visitée le 1/02/2016)
Autre site présentant la technique de coloration de Feulgen
http://jean-jacques.auclair.pagesperso-orange.fr/travaux/mitose/feulgen.htm (page visitée le 1/02/2016)
Métaphase
Télophase
1
/
4
100%