Fiche n°2

Sujet 2008_2_ljc : Elément fer
Fiche n°1 :
DESCRIPTIF DU SUJET DESTINE AUX PROFESSEURS
Démarche
Tp évalué niveau seconde, partie « Constitution de la matière »
Dans ce sujet on demande d’effectuer :
- réaliser des expériences autour de l’élément fer
- d’interpréter celle-ci afin d’illustrer la conservation de l’élément fer
Compétences
évaluées
Savoir-faire expérimentaux :
- Tests du dihydrogène et des ions du fer
- Allumer le bec bunsen
- Utilisation du bec bunsen (chauffage ou test de poudre métallique)
Préparation du poste
de travail
Il faut 9 postes de travail individuels (ou l’équivalent d’un ½ groupe de TP) avec un
sujet et une feuille réponse.
Déroulement de
l’épreuve
Le TP dure 1h15 min en parallèle.
Il est prévu 3 appels importants :
- Allumage du bec
- Chauffage d’une solution ou test avec la poudre de fer (selon groupe)
- Test du dihydrogène
Il est nécessaire de faire quelques vérifications en passant notamment les tests
complémentaires pour les expériences (3), (4) et (5).
Notation
L’évaluateur note en continu avec la grille de notation (8 points).
Le reste de la note est donné par le compte-rendu (12 points) dont le « bilan » de
chacune des réactions chimiques effectuées.
Remarques
- Concernant le déroulement :
Une fiche de TP « courante » sert de support à l’évaluation.
Bien expliquer que chaque binôme fait le TP en entier mais qu’il y a un partage du
travail et qu’ils travaillent en parallèle :
- l’élève à droite de la paillasse fait les réactions portant un numéro pair puis la 3
- l’élève à gauche de la paillasse fait les réactions portant un numéro impair
Ainsi tous font la réaction 3 mais les uns au début et les autres à la fin.
Bien leur dire que l’interprétation des expériences et le compte-rendu de celles-ci sont
d’importance (6 points !)
- Concernant la surveillance :
Pour éviter une certaine bousculade, notamment lors de la surveillance du
bec bunsen, bien signaler qu’il est possible de faire les expériences dans le
désordre
Demander aux élèves à vous montrer dès que possible le résultat des tests
d’identifications des ions. C’est souvent le plus délicat car il faut veiller à
pointer si le test a été fait ou pas (voir grille) à défaut de pouvoir sujet
immédiatement le résultat ; si impossible, voir comment cela appraît sur le
compte-rendu pour évaluer
- Concernant la remise en état du poste : Bien vérifier la propreté notamment des tubes
qui ont reçu de la limaille de fer. C’est un bon indicateur !
- Concernant le temps : La durée du TP est suffisante pour permettre une évaluation
objectiver sans que les élèves soient trop bousculés. Cependant, certains ont du mal à
finir la dernière partie plus théorique, d’où une dispersion des notes à ce niveau.

Sujet 2008_2_ljc : Elément fer
Fiche n°2 :
LISTE DE MATERIEL DESTINEE AUX PROFESSEURS ET AU PERSONNEL DE LABORATOIRE
Pour chaque poste :
Groupes ( x 9 )
- 12 tubes et support (car deux élèves à travailler en même temps)
- pipettes simples
- Solutions de sulfate de fer (+II) et de chlorure de fer (+III)
- Solution d’acide chlorhydrique assez concentrée pour attaque sur limaille : …………. mol.L-1
- Allumettes et bûchettes
- Solution de KMnO4 acidifié
- Bec bunsen
- Spatule
Paillasse professeur
- Solution d’iodure de potassium
- Empois d’amidon
- Rétroprojecteur
- Limaille de fer
- Feuilles de brouillon
Pour démonstration
- Fer métal
- Oxyde de fer
- Solution contenant des ions fer (+II)
- Solution contenant des ions fer (+III)

Sujet 2008_2_ljc : Elément fer
Fiche n°3 :
ÉNONCE DESTINE AU CANDIDAT
Ce sujet est accompagné d’une fiche réponse à compléter et à rendre avec la fiche TP ainsi
que la fiche notation complétée.
L’objectif est de faire le TP intitulé « Réactions autour du fer » afin de compléter le document en
partie masqué.
Pour cela, vous allez vous partager le travail :
- l’élève à droite de la paillasse fait les réactions portant un numéro pair puis la 3
- l’élève à gauche de la paillasse fait les réactions portant un numéro impair
1. Informations et démonstrations du professeur
Le professeur va te montrer divers composés en rapport avec l’élément fer : regarde bien, écoute
puis réponds aux questions.
2. Expériences
- Chaque membre du binôme réalise les expériences qui lui sont indiquées (voir en introduction de
cette fiche). Appeler le professeur pour lui montrer le résultat d’une expérience ou pour
certaines situations : allumage le bec bunsen, utilisation le bec (chauffage ou test de poudre
métallique) et test d’un gaz.
- Renseigner la fiche réponse au fur et à mesure.
Aide pour la réaction
:
- Placer une feuille sur la paillasse
- Placer horizontalement, quelques centimètres au-
dessus, la flamme du bec bunsen
- Saupoudrer à l’aide d’une feuille pliée en deux
- Comparer la couleur des grains ayant passer dans la
flamme et ceux restés intacts
- Eventuellement refaire l’opération plusieurs si cela n’est
pas net.
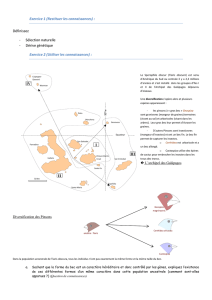
3. Conclusion
- Renseigner la fiche réponse pour conclure.
- Compléter l’organigramme vide en s’aidant de celui qui est « taché », des résultats d’expériences
ainsi que des équations chimiques à ajuster.
Nettoyer le matériel et ranger votre table

Sujet 2008_2_ljc : Elément fer
Fiche n°4 :
BAREME DE NOTATION DURANT LA SEANCE DESTINE A L’EVALUATEUR
Nom
Général
Tenue (blouse) et
attitude (debout)
* *
* *
* *
* *
* *
* *
* *
* *
Utilisation des
acides et bases
*
*
*
*
*
*
*
*
Remise en état du
poste
*
*
*
*
*
*
*
*
Allumage
du bec
bunsen
Virole fermée
*
*
*
*
*
*
*
*
Allumette au bec
*
*
*
*
*
*
*
*
Ouverture
complète du
« bon » robinet
*
*
*
*
*
*
*
*
Utilisation : virole
ouverte
*
*
*
*
*
*
*
*
Utilisation
du bec
bunsen
C comme chauffage
d’un tube
P comme test de
poudre
* * *
* * *
* * *
* * *
* * *
* * *
* * *
* * *
Ordre inverse des
étapes respecté
pour l’éteindre
*
*
*
*
*
*
*
*
Réaction
n°3
mais aussi
n° 4 et 5
Test du dihydro-
gène notamment
orientation du tube
* *
* *
* *
* *
* *
* *
* *
* *
Test des ions
notamment partage
du tube en deux
* *
* *
* *
* *
* *
* *
* *
* *
(3) : Test Fe2+ effectué
oui
oui
oui
oui
oui
oui
oui
oui
(4) : Test Fe3+ effectué
oui
oui
oui
oui
oui
oui
oui
oui
(5) : Test Fe2+ effectué
oui
oui
oui
oui
oui
oui
oui
oui
TOTAL
( sur 16 )
Remarques
* vaut 0,5 point

Sujet 2008_2_ljc : Elément fer
Fiche n°5 :
BAREME DESTINE A L’ÉVALUATEUR
TOTAL MANIPULATION
/ 12
Barème détaillé sur la fiche-réponse
TOTAL COMPTE-RENDU
/ 8
NOTE FINALE
/ 20
 6
6
 7
7
 8
8
1
/
8
100%