apoptose et cycle cellulaire

1
BIO CELL,POLY CYCLE CELL ET APOPTOSE ROCHICCIOLI ANNE-SOPHIE
P16 A 24 SPINA SARAH
APOPOTOSE ET CYCLE CELLULAIRE
INTRODUCTION
La cellule a à tout moment les protéines nécessaires pour induire sa mort (elle
déclanche seule l’apoptose ou par l’attaque par une autre cellule). Elle intègre
différents signaux qui conduisent à la création d’un équilibre entre prolifération
cellulaire, différenciation cellulaire et Apoptose. L’apoptose est un mécanisme
important dans l’homéostasie.
L’apoptose est un mécanisme universel tout comme la sénescence réplicative
c'est-à-dire qu’elle concerne tous les types cellulaires de tous les êtres vivants
Ex : un ver (caenorhbditis elegans) formé de 1090 cellules a servi de modèle pour
l’étude de l’apoptose. Au cours de son développement 131 cellules meurent par apoptose
quelque soit le ver observé. Conclusion : l’apoptose est un mécanisme génétiquement
programmé. C’est pourquoi on l’appelle aussi mort cellulaire programmée.
Remarque : Chez l’homme le SNC ainsi que les gamètes sont très sujets à l’apoptose.
1- morphologie d’une cellule qui subit l’apoptose
Une cellule qui entre en apoptose présente plusieurs caractéristiques :
- une diminution globale de son volume (se contracte, perd de l’eau)
- une diminution de son volume nucléaire (condensation nucléaire)
- elle se divise en petites vésicules membranaires, les corps apoptotiques. Dans
l’apoptose les organites ne sont donc pas libérés dans le milieu extra cellulaire (à
l’inverse de la nécrose où il y a un éclatement cellulaire,libération des
organites,ce qui crée l’inflammation) mais contenus dans les corps apoptotiques
qui seront digérés par des macrophages,fibroblastes. Le contenu de la cellule
n’étant pas libéré dans le milieu extra cellulaire, il n’y a pas de mécanisme de
chimiotactisme et donc pas de réaction inflammatoire qui accompagne l’apoptose.
- Il y a inhibition de contact c'est-à-dire que la cellule apoptotique se détache des
cellules voisines (elle s’isole) par perte de l’adhésion des intégrines.
- Le phénomène d’apoptose est isolé alors que la nécrose touche l’ensemble d’un
lobe
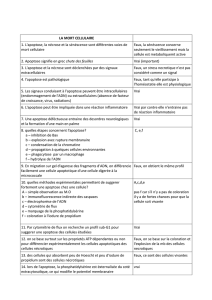
Différence entre nécrose et apoptose (voir tableau poly) info complémentaires :
- L’apoptose se déroule physiologiquement lors de la cornification qui est la
dernière étape de la maturation de l’épiderme et pathologiquement dans le cadre
des maladies de surcharge (la cellule ne pouvant plus faire face à l’afflux de
protéines non dégradées par ex, se suicide)

2
- La nécrose est toujours pathologique
- Lors de l’apoptose l’intégrité de la membrane plasmique est conservée car on
retrouve la membrane plasmique fragmentée en petites vésicules.
- Les organites et les enzymes lysosomiales sont présents dans les corps
apoptotiques
- L’apoptose est un mécanisme actif. Au cours de l’apoptose il y a consommation
d’ATP pour assurer les mécanismes de transcription, traduction et régulation.
2- principaux aspects biochimiques de l’apoptose
dépolarisation membranaire
perte de l’asymétrie de la membrane : il y a exposition de la phosphatidyl sérine (PS)
sur le versant exoplasmique de la membrane plasmique, ce qui correspond à un signal de
mort cellulaire programmée ;la cellule en apoptose ne dépense plus d’ATP pour
compenser le flip. la quantification de la PS sur le versant exoplasmique de la cellule
permet de déterminer le nombre de cellules en apoptose
Entrée massive de calcium dans le cytosol : favorise l’action de protéases qui sont
calcium dépendantes, les caspases (une douzaine chez l’Homme). Les caspases agissent
en cascade (des caspases initiatrices clivent d’autres caspases pour les activer).
La mitochondrie est un amplificateur de l’apoptose (voire déclancheuse) principalement
au niveau des cellules épithéliales. Elle inhibe :
- les molécules apoptotiques
- les molécules anti caspases
- le clivage des enzymes nucleosomales
Il existe 2 schémas de mort cellulaire programmée :
- induite par voie extra cellulaire(suicide oblgatoire,la cellule vis dangereusement
car expose en permanence des ligands de mort cellulaire comme Fas(CD95) )
- induite par le noyau de la cellule qui subit l’apoptose (voie qui passe
essentiellement par la protéine p53)
3- initiation membranaire de l’apoptose
le récepteur de mort : Fas ou CD95
Ce récepteur fixe Fas ligand encore appelé CD95 ligand. Sous l’effet de ce ligand le
récepteur se trimérise ce qui induit le recrutement de protéines adaptatrices au niveau
du domaine de mort (partie intra cytoplasmique du récepteur). Ces protéines
adaptatrices recrutent à leur tour des caspases initiatrices (la plus connue étant la
caspase8). Les caspases initiatrices sont sous forme de pro caspases qui s’autoactivent
au contact des domaines de mort. La forme activée est tétramérique(après coupure du
domaine NH2 terminal).
Le CD95L est exprimé par un faible nombre de cellules :
- lymphocytes T activés

3
- polynucléaires neutrophiles
- lymphocytes NK
p.18
Le Fas L est produit sous forme transmembranaire. Pour être libéré et agir sur la
cellule cible il est coupé par une métalloprotéase. Une fois libéré il peut se fixer au
récepteur Fas et induire l’apoptose. On parle alors d’apoptose paracrine.
La cellule peut autocouper le Fas L et réaliser une apoptose autocrine.
Une cellule ayant subit la fixation d’un Fas L peut sans diffusion de FasL par un
baiser de mort induire une apoptose fratricide
La neutralisation paracrine : la cellule sécrète une forme tronquée du Fas. Le Fas lie
le Fas L. ceci permet à la cellule de se protéger de la mort cellulaire induite par une
autre cellule (mort cellulaire par voie extracellulaire). Ce mécanisme est observé chez
les cellules tumorales.
Le complexe Fas /Fas L peut être rapidement endocytés avant même que les caspases
soient activées. Les cellules échappent alors à l’apoptose (cellules tumorales).
Les caspases
- les caspases ont une spécificité restreinte, elles coupent au niveau de résidus
aspartiques.
- Les caspases initiatrices se différencie des caspases effectrices car leur
domaine –NH2 terminal est plus long.
- Les caspases initiatrices s’autoactivent, elles forment un tétramère qui est actif,
protéolytique. Elles activent les caspases effectrices
- la caspase 3 activée clive les inhibiteurs des endonucléases et les molécules anti
apoptotiques donc active indirectement les endonucléases.
Transduction du signal de mort induit par les récepteurs membranaires
- on différencie 2 types cellulaires au sein desquels l’apoptose ne se déroule pas de
manière identique :
les cellules mésenchymateuses : l’apoptose ne fait pas intervenir les
mitochondries
les cellules épithéliales : l’apoptose fait intervenir les mitochondries.
- dans les cellules mésenchymateuse il y a trimérisation des récepteurs de mort,
recrutement des protéines adaptatrices, puis des caspases initiatrices et
effectrices. Le fibroblaste exprime une grande quantité de caspase 8 qui induit
directement la mort cellulaire
- dans la cellule épithéliale : l’expression de la caspase 8 étant plus faible, la
caspase 8 clive BID (protéine nucléosmale). Ce clivage permet à BID de se fixer à
la membrane mitochondriale externe. cette fixation a pour conséquence la
formation de pores par lesquels sort le cytochrome C. Dans le cytoplasme le

4
cytochrome C se complexe avec la pro caspase et l’APAF pour former
l’apoptosome qui active la caspase 9 qu’il contient.
Dans le cellule il y a un équilibre qui conditionne la survenue ou pas de l’apoptose :
- les protéines apoptotiques induisent la formation de pores dans la mitochondrie.
Elles sont cytosoliques
- les protéines anti apoptotiques empêchent la formation de pores dans la
mitochondrie. Elles sont situées sur la membrane externe de la mitochondrie.
La famille Bcl2
Bcl2 est une protéine anti apoptotique qui est sous forme dimérique.
Il peut s’agir ;
- d’un homodimère : Bcl2/Bcl2
- d’un hétérodimère : Bcl2/BAX
L’équilibre homodimère/hétérodimère conditionne la survenue de l’apoptose(l’ouverture
ou non des pores)
Schéma général du déclenchement de l’apoptose à partir des récepteurs de mort
1-interaction Fas/FAS L
2-trimérisation de Fas
3-activation des caspases initiatrices (pro caspase 8)
4-libération de la caspase 8 activée
Dans la cellule mésenchymateuse Dans la cellule épithéliale
5-activation des caspases effectrices 5-clivage de BID
(caspases3) 6-fixation de BID à a membrane externe
6- clivage de substrats critiques pour de la mitochondrie
La survie cellulaire 7-perméabilisation membranaire
7- fragmentation chromatinienne 8-Bcl2 s’oppose à l’ouverture des pores
8-mort cellulaire 9-BID et BAX induisent la sortie du
Cytochrome C
10-le cytochrome c participe à la
Formation de l’apoptosome
11-procaspase9 dans l’apoptosome est
Activée en caspase 9
12- activation des caspases effectrices
(caspases3)
13-clivage de substrats critiques pour
la survie cellulaire

5
14- fragmentation chromatinienne
15-mort cellulaire
Remarque : les dernières étapes dans la cellule mésenchymateuse et dans la cellule
épithéliale sont communes.
Il existe des protéases dont le rôle est de réguler l’activité des caspases. Il s’agit de
protéines régulatrices qui empêchent l’apoptosome et la caspase 3 de se former.
Fragmentation du noyau :p 21impossible de quantifier le pourcentage de cellules en apoptose
sur cette électrophorèse
4- induction de l’apoptose par le noyau
p53 est la protéine centrale de l’induction de l’apoptose par le noyau. Les cellules
tumorales déficientes en p53 échappent à l’apoptose.
P53 et apoptose
P53 est un facteur de transcription. Il induit :
- la transcription de gènes comme les protéines de l’apoptosome, ou BID et BAX,
inhibe Bcl2 et active donc la mort cellulaire par le système interne de la
mitochondrie.
- la transcription de Fas et est active donc la mort cellulaire par voie
extracellulaire.
- La transcription de MDM2. MDM2 activé induit l’ubiquitinylation de p53 qui doit
alors sortir du noyau.
5- méthode d’étude des cellules apoptotiques
Mesure de la quantité d’ADN
Le noyau de la cellule apoptotique se divise en fragments de noyau qui sont au sein de
vésicules membranaires (les corps apoptotiques) qui ont une quantité d’ADN inférieure
à 2n.On peut ainsi compter le nombre de vésicules et mesurer la concentration d’Adn ds
chaque vésicule.
Si dans un tissu on retrouve des quantités d’ADN inférieures à 2n cela signifie qu’il y
a des cellules en cours d’apoptose (attention aux gamètes qui ont une quantité d’ADN
égale à n)
mesure de la quantité d’ADN : iodure de propidium
- fixation des cellules
- perméabilisation membranaire
 6
6
 7
7
1
/
7
100%