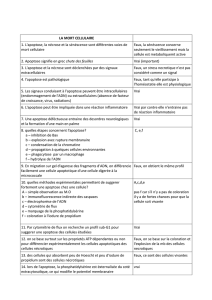
Cancérologie 15

Cancéro Page
1
sur 5
Cancérologie 15
Cours du 30/09/2011 de 16h à 17h Adrien Rohmer
Master Physiopathologie Antoine Molho
________________________________________________________________________________
Cancérologie
Mécanismes de l’apoptose
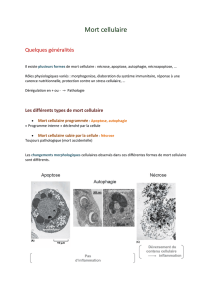
I Les notions de mort cellulaire
Différents types :
Evènements non génétiquement programmés :
Nécrose
C’est une mort cellulaire accidentelle faisant suite à une agression très violente.
Elle induit une lyse cellulaire provoquant une réaction inflammatoire.
On a un gonflement des organelles, puis une caryolyse et enfin une libération des enzymes
lysosomales qui entraîne la rupture des membranes et la désintégration de la cellule.
S’ensuit une réaction inflammatoire.
Sénescence :
C’est un arrêt irréversible de la prolifération cellulaire due à l’érosion des télomères.
Il concerne les locus INK4a ARF INK4b 35 kb sur le chromosome 9p21.
On a un épissage alternatif conduisant à l’expression de 3 gènes suppresseurs de tumeurs.
Autophagie :
C’est une vacuolisation d’une partie des constituants du cytoplasme . Les vacuoles sont
ensuite présentées aux lysosomes puis sont dégradées.
Elle peut correspondre à une adaptation de la cellule à son environnement (stress, manque
nutriments… ) ou peut être utilisée pour se débarrasser de mitochondries endommagées
pour ne pas qu’elles libèrent de produits oxygénés toxiques.
L’autophagie dépend de la voie de signalisation mTor.
Lorsqu’elle est excessive, elle conduit à la mort cellulaire.

Cancéro Page
2
sur 5
Apoptose :
C’est une mort cellulaire programmée qui a été décrite en 1972.
Cette description a été rendue possible par l’observation de nouvelles caractéristiques
morphologiques des cellules mourantes par apoptose différentes des cellules mortes par
nécrose.
C’est le résultat d’un programme endogène sous-jacent de mort cellulaire.
Il faut un signal émis pour induire l’apoptose !
Elle est Importante lors de l’embryogénèse (disparition des tissus entre les doigts…) mais
aussi pour la survie des organismes pluricellulaires.
Il existe ainsi un équilibre avec la prolifération cellulaire qui permet l’homéostasie tissulaire.
Elle utilise un programme génétique ciblé dans le cancer et a donc un rôle dans la
cancérogénèse et dans la thérapeutique (inhibition de l’apoptose).
II Caractéristiques de l’apoptose
Lors de l’apoptose, on observe :
Une condensation périnucléaire de la chromatine
Une diminution volume cellule
Une fragmentation de la cellule
Une phagocytose par les macrophages
Les macrophages reconnaissent les cellules apoptotiques grâce à un signal émis.
1) Modifications biochimiques de la membrane cytoplasmique :
- La première étape est un bourgeonnement
- Puis on a une externalisation de la phosphatidylsérine qui est anionique et initialement
sur le feuillet interne puis passe sur le feuillet externe. Elle est activée par une
translocase et on assiste à un déplacement de la sphingomyéline dans le sens
inverse.
On a effectué une expérience de marquage pour reconnaître une cellule en apoptose par
fixation sur la phosphatidylsérine d’une anexine 5 couplée à un fluorochrome.

Cancéro Page
3
sur 5
2) Modifications au niveau de la chromatine : fragmentation de l’ADN
3) Phagocytose des corps apoptotiques
2 étapes : reconnaissance + phagocytose
III Voies de signalisation de l’apoptose
1) La voie de signalisation interne de l’apoptose
3 gènes : Ced3, 4, 9 chez le ver.
3 principaux acteurs :
Caspases
Ce sont des protéases à cystéine qu’on retrouve dans leur site actif.
Elles clivent toujours après un acide aspartique.
Au niveau de leur site actif on trouve une séquence QACXG.
Les protéines cibles ont toujours un acide aspartique.
On retrouve aussi des séquences de clivage chez le substrat : L/VEXD DXXD.
On peut suivre l’apoptose grâce à des substrats fluorescents. Lorsqu’il est clivé, le
fluorochrome migre et on peut l’observer.
Inhibiteur de l’apoptose : Ac-DEVD-CHO
Elles sont toujours produites sous forme inactive. Les procaspases doivent être clivées pour
être activées.
L’ADN est digéré par des
endonucléases qui le coupent en
fragments de 180 à 200 paires de bases.
Elles coupent entre les nucléosomes.
La 2ème manière de repérer une cellule en
apoptose est d’utiliser la migration des
fragments d’ADN sur gel d’agarose.

Cancéro Page
4
sur 5
On retrouve ensuite 2 types de caspases :
- Les caspases iniatiatrices pour le signal
- Les caspases effectrices pour le clivage
Les caspases initiatrices ont 1 ou 2 prodomaines.
Les motifs en N term concernent le recrutement.
Les caspases effectrices 3, 6, 7 n’ont pas de prodomaines et leurs substrats ont un motif
DXXD.
Les protéines de la famille des gènes Bcl-2
Elles sont au nombre de 25 et ont un domaine de recrutement des caspases. Elles
permettent l’activation en cascade des caspases.
On retrouve 2 groupes :
- Les protéines pro-apoptotiques : Bax
- Les protéines anti-apoptotiques : Bcl-2
Elles forment une structure pour des intéractions entre les anti et les pro apoptotiques qui
aboutissent à leur inhibition.
Avec beaucoup de Bax, on a une inhibition de Bcl-2 et vice-versa. Cette balance est très
importante pour l’apoptose
Au cours de la cancéroénèse on assiste à une surexpression importante de Bcl-2.
La mitochondrie
C’est une bactérie ancestrale qui a colonisé une cellule pro eucaryote. La mitochondrie est
devenue l’usine à ATP
Elle joue un rôle important dans contrôle de l’apoptose.
Elle a 2 membranes avec un espace inter membranaire dans lequel peuvent être libérés des
substrats comme le cytochrome C qui induit l’apoptose.
La protéine Bax ouvre le canal et Bcl-2 le ferme. On a libération du cytochrome C dans le
cytoplasme qui va activer la caspase 9 qui est initiatrice et va activer les caspases 3 et 7
effectrices.
Protéine adaptatrice Apaf-1
Elle correspond à l’intermédiaire entre le cytochrome C et la caspase 9.
Elle a un site d’interaction avec le cytochrome C avec agrégation pour le recrutement de la
procaspase 9 qui aboutit à la création de l’apoptosome.
On a ensuite un clivage de protéines…

Cancéro Page
5
sur 5
2) La voie extrinsèque de l’apoptose
Les récepteurs à domaine de mort
Ils appartiennent à la superfamille du TnfR et possèdent dans leur partie intra-cytoplasmique
une région appelée domaine de mort DD.
Il y recrutement des protéines FADD qui vont activer les caspases 8 et 10 initiatrices.
Contrôles sur les caspases :
- Bcl-2
- La protéine mitochondriale Smac/DIABLO qui inhibe les IAPs qui sont inhibitrices de
l’apoptose en inhibant les caspases effectrices
- Les protéines IAPs (80 acides aminés)
La protéine p53
Les voies de signalisation de l’apoptose sont induites par p53.
Des cascades stabilisent p53 et forment un complexe d’activation transcriptionnelle. Elles
induisent ensuite l’activation de Bax qui est pro-apoptotique.
On arrive à l’arrêt du cycle cellulaire et à l’apoptose.
Pour la thérapeutique : Quand p53 est modifiée, résistance à l’induction de l’apoptose.
1
/
5
100%