Synthèse du méthanoate d'éthyle : Exercice de chimie

17/04/2017 582697618 1/3
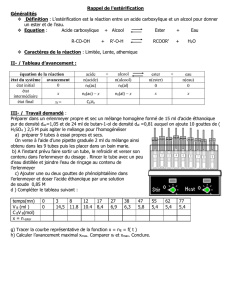
CHIMIE
SYNTHESE DU METHANOATE D’ETHYLE
Chap.9
I. Travail expérimental
Le méthanoate d’éthyle (ou formiate d’éthyle) est un ester à odeur de rhum
Données :
masse molaire
M en g.mol-1
Masse volumique
en g.cm-3
Température
d’ébullition en °C
Solubilité dans l’eau
Acide méthanoïque
46
1,22
100,7
totale
éthanol
46
0,79
78,5
totale
méthanoate d’éthyle
74
0,91
54,3
faible
On remarque que la température d’ébullition de l’ester est inférieure à celles des autres produits, on pourra
donc le séparer par distillation fractionnée au fur et à mesure de sa formation par la réaction d’estérification.
Il est nécessaire de mettre des lunettes et des gants de protection pour la manipulation des acides concentrés
et de se placer sous la hotte.
1) Peser et noter la masse m0 de l’éprouvette graduée avant de commencer la distillation.
m0 = ............ g
Dans un ballon, on introduit 15,0 mL d’éthanol contenue dans un tube à essais.
Avec des gants et des lunettes, introduire 10,0 mL d’acide méthanoïque (ou acide formique) pur contenu
dans un autre tube à essais et 0,5 mL d’acide sulfurique concentré à l’aide d’une pipette.
Ajouter quelques grains de pierre ponce pour favoriser le mélange des réactifs.
On réalise le montage de distillation fractionnée (voir figure ci-dessous ). Faire vérifier votre montage
(mettre un entonnoir sur l’éprouvette graduée).
Faire circuler l’eau dans le condenseur avant de chauffer.
Placer le thermostat sur 4 en surveillant, de temps en temps, la température en haut de la colonne.

17/04/2017 582697618 2/3
Lorsque la distillation commence, la température se fixe à 54 °C en haut de la colonne. La distillation est
terminée quand la température descend (vers 40°C) bien en dessous de 54°C.
2) Mesurer le volume d’ester recueilli : V = ............ mL
3) Peser et noter la masse m’ de l’éprouvette graduée après la distillation. m’ = ............ g

17/04/2017 582697618 3/3
II. Etude théorique
1) Ecrire l’équation de la réaction d’estérification.
2) Cette réaction d’estérification étant lente, citer deux facteurs cinétiques utilisés lors de cette expérience.
3) Donner l’expression de la constante K de cet équilibre sachant que l’eau est ici un des produits formés et pas
un solvant.
4) Sachant que cette constante K = 4 pour cette réaction, Quelle conclusion en tire-t-on sur la réaction ?
5) Calculer les quantités de matière initiales des réactifs en présence. Quelle conclusion peut-on en tirer ?
Si la réaction était totale, quelle serait la masse m1 d’ester formé ?
6) Si l’ester n’était pas distillé au fur et à mesure qu’il se forme :
7) Construire un tableau d’avancement. Exprimer l’avancement final en fonction de K. En déduire la valeur de
l’avancement final dans ces conditions.
8) Quel serait le taux d’avancement final Quelle serait alors la masse m2 de l’ ester formé ?
En fait, on distille l’ester (méthanoate d’éthyle) dont la température d’ébullition est de 54,3 °C au fur et à
mesure qu’il se forme.
9) Quel est l’intérêt de cette opération ?
10) Que vaut QR au cours de la distillation ? Comparer QR avec la constante d’équilibre de cette réaction? Quelle
conclusion en tire-t-on?
III. Mise en commun des résultats
1) Déterminer la quantité initiale (en mol) d’acide utilisé nacide.
2) Déterminer la quantité initiale (en mol) d’alcool utilisé nalcool.
3) En déduire le réactif limitant et l’avancement maximal
x
max de la réaction.
4) En déduire le taux d’avancement final de cette synthèse.
5) Déterminer la masse volumique µ de l’ester (en g.cm-3) et la comparer avec la valeur théorique.
Groupe
m0 (g)
m’ (g)
masse d’ester (g)
nacide (mol)
nalcool (mol)
nester (mol)
(%)
µ (en g.cm-3)
1
2
3
4
5
6
7
8
9
moyenne
1
/
3
100%