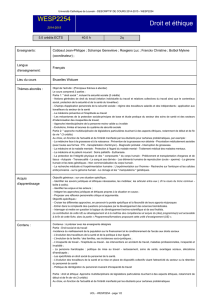
Version abrégée en français du protocole original d`étude

Version abrégée en français du protocole original d’étude dans une autre langue
Cette version abrégée (4-10 pages) doit être rédigée de manière à être compréhensible pour l’ensemble
de la commission d’éthique (qui comporte aussi des laïcs en médecine) et à leur permettre d’évaluer les
aspects éthiques de l’étude
Le modèle doit donc être utilisé de manière spécifique pour chaque étude
Les différents points doivent être adaptés à chaque type d'étude
Titre de l’étude
Numéro du protocole
Noms et prénoms de l’investigateur
responsable et des co-investigateurs
Date
1. Mise en perspective de l’étude
2. Hypothèse
3. But de l’étude
4. Objectif primaire
5. Objectif secondaire
6. Design de l’étude
7. Critères d’inclusion /d’exclusion des patients
______________________________________________________________________________________
8. Plan général de l’étude :
a. Déroulement de l'étude (examens spécifiques/ non-spécifiques à l'étude), avec schéma
b. Critères déterminant le nombre de sujets/patients inclus dans l’étude (à visée statistique)
c. Modalités de recrutement des patients
______________________________________________________________________________________
9. Médicaments utilisés lors de l’étude/Medical Device : résumer l’état des connaissances à leur sujet
(propriétés pharmacologiques, toxicité pré-clinique, pharmacocinétique), le nombre de sujets/patients à
qui il a été administré et pour combien de temps, la posologie et la durée d’administration
______________________________________________________________________________________
10. Evaluation des Risques/Charges/Inconvénients et aspect éthiques
11. Couverture des dommages éventuels
12. Traitement des données personnelles et biologiques (confidentialité, transfert à l’étranger, biobanque)

Version du 15.03.2013
13. Prise en charge des frais (spécifier les prestations à charge du promoteur et celles à charge du patient
et de son assurance maladie)
14. Sources de financement et rétribution
15. Modalités d’informations des praticiens installés si leurs patients sont impliqués
16. Modalités d’informations au personnel médical et paramédical
1
/
2
100%