Conférences de J.-L. TEILLAUD

Journées nationales de SVT des 5 et 6 mars 2002
Les réponses immunitaires
au cours de l’infection par le VIH
Jean-Luc TEILLAUD
Directeur de recherche, unité INSERM 255 (Paris)
C’est un grand plaisir pour moi d’être devant vous aujourd’hui.
L’épidémie : état des lieux
En guise d’introduction, j’ai préparé une série de diapositives qui présentent l’état actuel de
l’épidémie VIH, afin de remettre le sujet de cette conférence en perspective. Le VIH est loin
d’être une maladie anecdotique ou en voie de disparition, comme on a tendance à le croire dans
les pays développés : c’est un problème de santé publique d’envergure mondiale, de plus en plus
préoccupant dans certaines régions du monde, en particulier en Russie et dans de nombreux
pays en voie de développement (en Asie et en Amérique du Sud), majeur en Afrique (par
exemple en Afrique du Sud).
Selon les chiffres de l’OMS et de l’ONU-Sida, 40 millions de personnes seraient séropositives
ou atteintes par le Sida dans le monde (document 1). Ce chiffre est probablement inférieur à la
réalité. En 2001, pas moins de 5 millions de cas nouveaux ont été recensés. Sur ces 40 millions
de personnes, 37,2 millions sont des adultes, dont 17,6 millions de femmes. 2,7 millions
d’enfants de moins de 15 ans sont également porteurs du virus. En outre, un changement majeur
s’est produit durant ces quinze dernières années. Auparavant, cette maladie était surtout
répandue dans les communautés homosexuelles. La diffusion du virus dans le monde
hétérosexuel continue à s’amplifier de manière dramatique : il y a dix ans, un malade sur sept
était une femme, contre un sur trois aujourd’hui.
En 2001 (document 2), les pays les plus touchés ont été les pays en voie de développement, qui
sont aussi les plus dépourvus en termes d’infrastructures sanitaires, éducatives et sociales. 95 %
des 14 000 nouveaux cas déclarés chaque jour le sont dans les pays du Tiers-Monde ou au sein
de la Fédération de Russie.
Le VIH a été responsable de la mort de 21,8 millions de personnes entre 1980 et 2000, dont les
trois quarts en Afrique subsaharienne (document 3). La situation est catastrophique : 2,7
millions d’enfants seraient contaminés et susceptibles de développer la maladie du SIDA : vous
devez insister sur cet aspect, sachant que vous vous adressez, en tant qu’enseignants, à des
adolescents.
En corollaire, les enfants sont de plus en plus touchés par la maladie : 2 000 cas recensés en
2001 concernent des enfants de moins de 15 ans. Ces infections résultent généralement de
transmissions de mères à enfants (document 4).
Le VIH : un défi au système immunitaire
Le VIH signifie virus d’immunodéficience humaine (document 5). Au début des années 1980,
nous avions assisté à une controverse entre les laboratoires français et américains au sujet du
nom de ce virus. Le laboratoire français du Département de rétrovirologie de l’Institut Pasteur
dirigé par le Professeur Luc Montagnier l’avait initialement appelé « LymphAdenopathy Virus
ou «LAV». De son côté, le laboratoire américain du Professeur Roberto Gallo pensait qu’il
s’agissait d’un virus de la famille des HTLV («Human T Leukemia Virus»). Finalement, une
négociation ardue entre français et américains a abouti au choix du nom VIH (HIV en anglais).
Le VIH est l’agent causal du SIDA. Il fait partie de la famille des rétrovirus et plus

Journées nationales de SVT des 5 et 6 mars 2002
particulièrement de celle des lentivirus car il s’agit d’un virus dont le cycle de développement
est particulièrement lent (document 6). Il existe en fait deux types de virus, le VIH1 et le VIH2,
sachant que le VIH 2 est beaucoup moins répandu que le VIH 1. Ce virus a été localisé
initialement en Afrique occidentale francophone. Il est à noter que des équivalents du HIV
existent dans le monde animal, comme le SIV des primates non humains (singes) ou le FIV, qui
atteint les chats dans la région du pourtour méditerranéen. Ces équivalents servent d’ailleurs
encore de modèles d’étude à de nombreux laboratoires (document 7).
L’analyse du génome du VIH permet de présenter les protéines capables d’initier des réponses
immunitaires humorales et/ou cellulaires (document 8). Ce génome contient 3 grandes
catégories de protéines : les protéines internes, les enzymes virales (la transcriptase inverse,
découverte dans les rétrovirus il y a près de 30 ans par David Baltimore, Renato Dulbecco et
Howard Temin) et les glycoprotéines d’enveloppe, dont la propriété qui intéresse les
immunologistes est de constituer des cibles privilégiées du système immunitaire (gp 120 et
gp 41) (document 9). Lorsqu’un virus entre dans une cellule, il faut alors qu’il exprime à sa
surface une protéine qui se lie à un (des) récepteur(s) situé(s) sur la cellule pour laquelle le virus
possède un tropisme. C’est le cas de la gp 120 qui joue donc un rôle essentiel dans l’infection.
Le cycle viral comprend plusieurs étapes successives (document 10) : pénétration dans la
cellule, rétro-transcription, intégration dans le génome sous forme de pro-virus qui peut ainsi
subsister sous forme quiescente dans les cellules infectées pendant très longtemps (cellules
« réservoirs»). L’activation de la réplication virale (due par exemple à une activation du
lymphocyte T infecté par l’interleukine 2, ou IL-2) se traduit par une expression de protéines
virales, l’assemblage des particules infectieuses, leur bourgeonnement à la surface de la cellule
infectée, suivi de leur production dans le milieu extracellulaire.
Les différents types de traitement
A l’heure actuelle, le traitement de référence (document 11) est constitué par les tri-thérapies,
qui sont fondées sur l’utilisation d’inhibiteurs de la transcriptase inverse, nucléosidiques ou non,
et d’un inhibiteur de protéases (enzymes qui facilitent la maturation de certaines protéines
virales au moment de la fabrication des particules infectieuses). La tri-thérapie est une grande
avancée dans le traitement du Sida, qui a eu cependant deux effets diamétralement opposés :
- une survie accrue de nombreux patients, avec néanmoins des effets secondaires sévères
dans de nombreux cas. Cela peut à l’arrêt du traitement par le médecin, du fait des problèmes
de tolérance, ou à des défauts d’observance par le patient (certains patients, confrontés aux effets
secondaires, ont tendance à ne plus respecter la prescription). Un autre problème lié aux tri-
thérapies est le phénomène "d’échappement", qui induit des résistances à la tri-thérapie et ne
permet pas d’envisager, à court ou moyen terme, de stratégie vaccinale efficace. Le VIH est en
effet capable de muter son génome avec une fréquence élevée. Il peut donc échapper
rapidement soit à des stratégies vaccinales, soit à des molécules thérapeutiques interférant avec
certaines structures protéiques du virus.
- dans nos pays occidentaux, la survie accrue des patients s’est accompagnée ces dernières
années d’une banalisation très forte de la maladie. Cela est inquiétant car on note à l’heure
actuelle un relâchement de la vigilance au sein des communautés homosexuelles. Alors que
nous avions réussi à stabiliser l’épidémie dans les pays développés, nous assistons actuellement
à un accroissement du nombre d’infections et une recrudescence de maladies infectieuses dites
"opportunistes" (c’est à dire accompagnant le développement de l’immuno-déficience), telles
que la syphilis.
En ce qui concerne la vaccination, qui intéresse en premier lieu les immunologistes, de
nombreuses expérimentations sont menées sur les singes. Cependant il existe un problème lié à
l’échappement (deux articles publiés dans la revue Nature de janvier 2002 en ont fait mention).
L’émergence d’une réponse immunitaire fondée sur les lymphocytes T cytotoxiques est difficile
à obtenir du fait des capacités extraordinaires de mutation du virus. En effet, même si l’on repère
des peptides issus de protéines du virus qui peuvent représenter des cibles vaccinales, les régions
du génome viral codant ces peptides mutent tellement rapidement que ceux-ci ne sont
rapidement plus reconnus par les récepteurs des lymphocytes T sélectionnés lors de la

Journées nationales de SVT des 5 et 6 mars 2002
vaccination. Du coup, ces virus échappent totalement au contrôle de l’immunité T. Cela reste le
problème majeur de l’obtention d’une vaccination efficace.
Nous sommes actuellement à la recherche de nouveaux traitements fondés sur les inhibiteurs
viraux intervenant à différentes étapes du processus de l’infection virale : entrée, fusion, et
intégration. Des travaux sont notamment en cours en vue de mettre au point des molécules
visant à empêcher l’entrée des particules infectieuses dans les lymphocytes T, à partir des
connaissances nouvellement acquises sur les molécules virales et leurs récepteurs présents à la
surface des lymphocytes T.
Même si le choix du VIH, dans un cadre d’enseignement des bases fondamentales de
l’immunologie, peut être discuté, il est certain qu’il a le double avantage de permettre l’analyse
d’aspects importants de l’immunologie cellulaire et humorale (même si cela se fait par la lunette
d’un dérèglement majeur du système immunitaire) et de sensibiliser l’une des tranches les plus à
risque de la population à l’infection par le VIH.
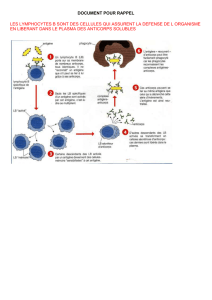
Les problématiques d’immunologie
Le VIH est un défi au système immunitaire (document 12) car sa cible est précisément
constituée par une cellule centrale dans la mise en place de réponses immunitaires, à savoir une
sous-population de lymphocytes T que l’on a appelée, depuis le début des années 1980, CD4
(CD pour «cluster of differentiation »). Ce virus est capable d’infecter cette sous-population de
lymphocytes T4 grâce à la protéine CD4, exprimée à la surface de ceux-ci. Cela passe par une
interaction, qui a été et reste très étudiée, entre la protéine CD4 et la gp 120. L’on connaît
relativement bien les régions de la gp 120 et de CD4 impliquées dans cette interaction, ainsi que
la dynamique et les changements conformationnels que cette interaction induit.
L’interaction entre VIH et CD4 nous permet de nous pencher plus en détail sur les
lymphocytes T. Le lymphocyte T CD4 est central à ce que l’on appelle la réponse "acquise".
Auparavant, il était fréquent d’entendre les termes d’immunité spécifique ou non spécifique.
Oubliez-les : nous parlons désormais d’immunité acquise ou immunité adaptative concernant les
réactions impliquent lymphocytes T et B.
Le lymphocyte CD4 se divise schématiquement en deux sous-populations : TH1 et TH2. Ces
dernières ont un rôle d’aide aux réponses anticorps, qui impliquent les lymphocytes B, ou aux
réponses T cytotoxiques, qui sont dues aux lymphocytes T dont la surface est dotée de
molécules CD 8.
La molécule CD4 est intéressante pour les immunologistes car elle participe directement aux
interactions avec les "CPA" (cellules présentatrices d’antigènes). Derrière ce terme sont
regroupés les monocytes, les macrophages, les cellules dendritiques et les lymphocytes B,
également capables de présenter des antigènes outre leur capacité à se différencier en
plasmocytes producteurs d’anticorps. Toutes ces cellules sont capables par différents
mécanismes d’absorber (par endocytose, pinocytose et/ou phagocytose) des antigènes viraux,
microbiens, et de les découper, par un système extrêmement sophistiqué -principalement via les
endosomes. Ces petites vésicules ont pour rôle de découper des protéines en peptides, qui
s’associent alors à des molécules du complexe majeur d’histocompatibilité (molécules de
classe 2). Le complexe est ensuite remonté et exposé à la surface des cellules (monocytes,
macrophages, cellules dendritiques et lymphocytes B). A ce moment-là, le complexe va être
reconnu par le RCT, le récepteur T de l’antigène, dont la structure ressemble à celle des
immunoglobulines et n’est pas au programme de la classe terminale. Cette structure associe des
chaînes alpha et bêta, ou gamma et delta. L’association des régions variables alpha et beta ou
delta et gamma permet la formation d’un site conformationnel capable de lier le complexe
peptide-molécule de classe 2 du complexe majeur d’histocompatibilité. Avec l’aide d’autres
molécules, notamment le complexe multimoléculaire CD3, la molécule CD 4 ou encore les
molécules d’adhérence et de costimulation – la cinétique est complexe – le lymphocyte T CD4
va être activé, via une interaction spécifique, qui exige une complémentarité entre le récepteur T
de l’antigène et le peptide de classe 2. Molécules CD4, molécules d’adhérence et molécules de
co-stimulation permettront une adhérence très ferme entre les deux types cellulaires. Elles ne
seront pas, du point de vue de leur interaction, liées aux spécificités du peptide mais seront

Journées nationales de SVT des 5 et 6 mars 2002
capables de renforcer la signalisation (d’où leur nom de molécules de costimulation) qui
s’effectue principalement via le complexe CD3. Il faut souligner que ces différentes molécules
vont se regrouper à la surface cellulaire autour du RCT suite à l’interaction de ce dernier avec le
peptide associé aux molécules de classe II, selon une cinétique très précise, conduisant ainsi à la
formation de ce que certains immunologistes ont appelé récemment, peut-être improprement, la
"synapse immunologique" (ceci n’est pas au programme de terminale).
Au niveau du lymphocyte T vont alors être activées différentes voies de transduction et de
signalisation. In fine, nous pouvons assister, selon les densités des récepteurs de l’antigène et
selon la force de l’interaction avec le peptide, à une activation de programmes qui peuvent être
des programmes de production des protéines que l’on appelle des cytokines (hormones
peptidiques : IL-2, IL-4, IL-10, Interféron gamma). Ces dernières vont être sécrétées par les
lymphocytes T et vont être capables de donner des signaux d’information à des cellules proches
ou à distance dotées de récepteurs spécifiques de ces cytokines. Ces cellules vont alors entrer
dans une dynamique d’activation, de différenciation ou de prolifération, voire les trois à la fois.
La plus célèbre de ces cytokines est l’interleukine 2 (IL-2), qui a été l’une des découvertes
majeures de l’équipe du Professeur Gallo, grand scientifique italo-américain, qui considère qu’il
est co-découvreur du VIH avec le Professeur Luc Montagnier (soulignons cependant que cette
notion de "co-découverte" est contestée par de nombreux chercheurs qui considèrent que le
virus isolé par l’équipe française, envoyé au laboratoire américain dans le cadre des nombreuses
collaborations et échanges qui existent entre les équipes de recherche, est celui ensuite "isolé"
par l’équipe américaine). L’interleukine 2 joue un rôle important dans l’activation et la
prolifération des lymphocytes T exprimant à leur surface le récepteur de l’IL-2 (CD25).
Toutes ces cytokines vont mettre en activité et en réseau un certain nombre de partenaires. Ces
partenaires sont les cellules de l’immunité acquise et de l’immunité innée.
Immunité innée et acquise
L’immunité innée était appelée auparavant immunité non spécifique. En fait, cette définition
reflétait l’ignorance des immunologistes car un macrophage, une cellule dendritique, un
polynucléaire ou un monocyte sont capables de distinguer un virus, une bactérie, un
champignon, voire une cellule infectée ou "abimée" de nos propres cellules saines. Il existe donc
bien une spécificité de reconnaissance, même si elle n’est pas du même ordre que celle de la
reconnaissance effectuée par des lymphocytes B ou T. Le glissement sémantique entre
immunité "non spécifique" et "innée" est justifié par le fait que l’on commence désormais à
décrypter les récepteurs responsables de l’activation des cellules du système inné (macrophages,
polynucléaires, monocytes, cellules dendritiques, etc.). Il s’agit de structures assez complexes
dénommées "Toll receptors". Elles ont été mises en évidence au départ par des chercheurs qui
travaillaient sur la drosophile, qui n’a pas d’immunité spécifique mais qui possède un système
immunitaire plus primitif capable d’être stimulé en cas d’infection par un virus ou des bactéries.
Cette notion est importante : l’immunité innée n’est pas liée à un déficit de spécificité ou de
reconnaissance. Les mécanismes de reconnaissance ne sont pas les mêmes que ceux des
lymphocytes B et T. En fait, même à la surface de cellules de mammifères, il existe des
récepteurs de glycolipides, de peptidoglycanes ou d’acides nucléiques bactériens et viraux
capables de fixer ces molécules et de "signaler" cet événement aux cellules de l’immunité innée,
en vue de les activer. Les processus qui découlent de cette activation sont de deux types : les
processus de phagocytose et les processus inflammatoires locaux (recrutement de cellules sur le
site de l’infection).
Ces cellules de l’immunité innée sont en fait également impliquées dans l’infection par le VIH.
On savait depuis la description du CD4 comme récepteur principal du VIH via la gp 120, que
les choses n’étaient sans doute pas aussi simples. L’existence de co-récepteurs était considérée
comme fortement probable. Des équipes se sont penchées sur la question et, actuellement, un
consensus existe sur l’existence de ces co-récepteurs. Un article récent, paru dans Science,
montre que la présence de ces co-récepteurs est même suffisante pour assurer la pénétration du
VIH dans un certain nombre de cellules, notamment via des interactions avec la protéine virale
qu’est la gp 120.

Journées nationales de SVT des 5 et 6 mars 2002
Ces récepteurs n’ont pas été fabriqués par le système immunitaire des mammifères uniquement
pour recevoir le VIH. Ils appartiennent à une famille de molécules qui a pris beaucoup
d’importance durant ces dernières années dans le domaine de l’immunité : les récepteurs de
chimiokines. Ces dernières sont de petites protéines qui assurent principalement des fonctions
de migration. Actuellement, deux récepteurs de chimiokines sont identifiés comme étant des co-
récepteurs du VIH : le CXCR4 et le CCR5 (document 13). Ces récepteurs de chimiokines
permettent de mieux cerner la physiopathologie du VIH. En effet, le CXCR4 est présent de
façon très ubiquitaire sur les lymphocytes T. Quant au CCR5, il est présent non seulement sur
les lymphocytes T mais aussi sur les cellules de l’immunité innée que sont les monocytes, les
cellules dendritiques et les macrophages.
Les immunologistes ont très rapidement eu connaissance du fait que l’infection des
lymphocytes T était particulièrement productive en particules infectieuses. Dans la population
des monocytes, macrophages et cellules dendritiques, cette infection est beaucoup plus latente.
Ils en ont conclu que ces cellules servaient de réservoirs au VIH, ce qui soulève un problème
majeur en termes de stratégie thérapeutique. Il est probablement très difficile d’éradiquer les
VIH ayant infecté des monocytes. Il y a dix ans, les immunologistes partaient du principe que le
CD4 était le récepteur du VIH et que les lymphocytes T étaient les cellules infectées (à l’époque,
il était cependant déjà possible de détecter la présence du VIH dans les monocytes dont certains
expriment le CD4). Désormais, nous savons qu'il faut non seulement s’attaquer aux
lymphocytes T CD4+ infectés mais aussi éradiquer les virus ayant infecté les monocytes et les
cellules dérivées de la même lignée (macrophages et cellules dendritiques).
Pour revenir à notre propos précédent, ces récepteurs ont des ligands qui sont appelés les
chimiokines. De nombreux récepteurs de ce type ont été découverts. L’ensemble de ces
récepteurs joue un rôle très important dans le développement de l’immunité innée (document
14). Ils sont tous constitués sur le même modèle : ils ressemblent à de petits tonneaux, constitués
de sept domaines transmembranaires, une petite partie extracellulaire, un domaine
intracellulaire.
A l’heure actuelle, les travaux de recherche menés sur les chimiokines sont essentiellement
centrés sur leur capacité de migration (document 15). En cas de blessure ou d’infection se
produit une réaction immédiate, qui se traduit par la libération des chimiokines, notamment par
le biais des kératinocytes et de polynucléaires neutrophiles, qui elles-mêmes créent un gradient.
Sachant que, dans le flux sanguin, se trouvent des leucocytes dotés de récepteurs de chimiokines
(lymphocytes, monocytes), nous assistons alors, au niveau du site de l’infection, à l’arrivée de
ces cellules : les leucocytes présents dans la circulation vont subir un phénomène de roulement
puis d’adhérence -notamment grâce à une famille de molécules appelées les intégrines,
exprimées sur les cellules de l’endothélium vasculaire-, et enfin un phénomène d’extravasation
et de migration. Certaines expériences montrent bien que le rôle des chimiokines est très
important dans le cadre de la migration vers les sites infectieux, voire vers les sites tumoraux. A
l’heure actuelle, nombre de manipulations en laboratoire visent à mieux comprendre les
dérèglements de la production de chimiokines ou l’expression de leurs récepteurs dans
différentes situations pathologiques, qui pourraient rendre compte d’une non-stimulation des
cellules de l’immunité innée.
Les cibles du VIH
Les cibles du VIH sont doubles (document 16) :
D’une part, les souches lymphocytotropes (infectant les cellules T CD4+) : les lymphocytes sont
détruits soit directement, soit après activation cellulaire libérant des particules infectieuses de
façon massive.
D’autre part, les souches monocytotropes : certaines souches de virus sont dotées des deux types
de tropisme. Dans ce cas, l’infection du compartiment monocytaire sera moindre, la réplication
sera faible, mais le virus bénéficiera d’un réservoir cellulaire, en se maintenant sous forme
latente. Les monocytes infectés auront donc la capacité de reproduire des particules infectieuses,
qui contamineront le pool de lymphocytes CD4, si ce dernier s’est reconstitué.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%