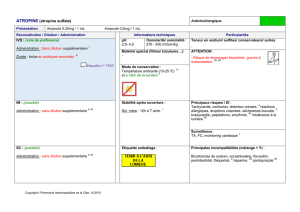
l`atmosphere et la

Un acide très utilisé : l’acide chlorhydrique. Page 1 sur 2
pH2= 4
Objectifs : Savoir réaliser une dilution en toute sécurité.
Qu’est-ce que l’acide Chlorhydrique ?
En dissolvant le gaz chlorure d’hydrogène pur (HCL) dans de l’eau distillée
(constituée que de molécule d’eau), on obtient une solution aqueuse contenant des
cations H+ et des anions Cl-, ainsi que des molécule d’eau : c’est de l’acide
chlorhydrique, de formule (H2O+H++Cl-) ou simplement de chlorure (H++Cl-).
I- Dilution d’une solution d’acide.
Pour effectuer une dilution, il faut toujours verser, avec beaucoup de précaution,
l’acide (ou la base : soude par exemple) dans de l’eau, mais jamais l’inverse.
1- Expérience :
a) Prélevez 10 ml de la solution S0 avec une pipette, puis versez ces 10 ml dans 50
ml (environ) d’eau distillée et complétez avec de l’eau distillée pour obtenir 100 ml de
mélange. Bien homogénéiser le mélange obtenu avec un agitateur : on obtient la solution
S1 c’est-à-dire la solution S0 diluée 10 fois. Notez S1 la solution obtenue.
b) Prélevez 10 ml de la solution S1 avec une pipette, puis versez ces 10 ml dans 50 ml
(environ) d’eau distillée et complétez avec de l’eau distillée pour obtenir 100 ml de
mélange. Bien homogénéiser le mélange obtenu avec un agitateur : on obtient la solution
S2 c’est-à-dire la solution S1 diluée 10 fois (So diluée 100 fois). Notez S2 la solution.
d) Mesurez le pH de chaque solution.
Solution
S0
S1
S2
pH
2
3
4
pH1= 3
pHo = 2
S3
m
l
m
l
So
50mL
100 mL
S1
50 mL
100 mL
S1
S2
…………………………….
La chimie, science de la
transformation de la matière.
Chapitre XI
UN ACIDE TRÈS UTILISÉ:
L’ACIDE CHLORHYDRIQUE

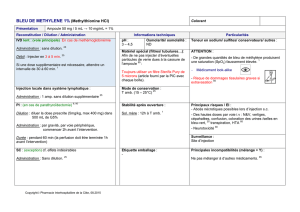
Un acide très utilisé : l’acide chlorhydrique. Page 2 sur 2
2- Observation :
Nous avons effectué deux dilutions d’une solution d’acide : le pH est passé de 2 à 3,
puis à 4.
3-Interprétation :
Dans chaque bécher, nous disposons de 100 ml de solution aqueuse d’acide
chlorhydrique alors que le nombre d’ions hydrogène H+ a été divisé par 10 lors de la
dilution : le pH augmente quand la concentration en ions hydrogène H+ diminue..
4- Conclusion :
Lors de la dilution d’un acide dans l’eau, le pH augmente car la concentration en ion
hydrogène diminue. La dilution d’une solution acide donne un e solution acide.
II- Dilution et sécurité :
1- Expérience :
Deux béchers contiennent de l’eau distillée à la température de 21°C. Versons, dans
l’un, du chlorure de sodium (sel de cuisine) et, dans l’autre de l’acide chlorhydrique.
Agitons avec un agitateur, puis mesurons la température de chacune des solutions
obtenues.
2- Observation :
La température n’évolue pas dans le bécher contenant la solution de chlorure de
sodium, mais on constate une augmentation de 6°C dans la solution d’acide.
3-Interprétation :
La solution d’eau salée se fait sans dégagement de chaleur : la dissolution est
athermique.
Pour la solution d’acide, il y’a augmentation de température, donc dégagement de
chaleur : la dissolution est exothermique.
4- Conclusion :
Certains acides, comme l’acide chlorhydrique, sont dangereux. Leur dilution dans
l’eau est très exothermique.
III- Conclusion :
Une solution acide à un pH inférieur à 7. Elle contient plus d’ions hydrogène que
d’ions hydroxyde. La dilution d’un acide pur ou concentré est très exothermique : il
faut toujours verser de l’acide dans beaucoup d’eau, et non l’inverse.
eau distillée
eau distillée + acide
eau distillée
eau distillée + sel
T= 21°C
T= 21°C
T= 21°C
T= 27°C
1
/
2
100%