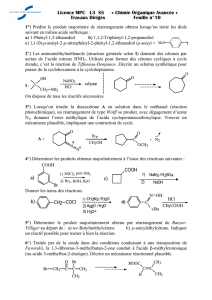
Le développement des lymphocytes T

1
Récepteur B, Récepteur T:
structure et réarrangement.
Lymphocytes B, Lymphocytes T:
Ontogénie, répertoire, tolérance.
UE:Immunologie
Master physiopathologie cellulaire et moléculaire
Mirjana Radosavljevic
La reconnaissance de l’ antigène par
un anticorps
PLAN:
• Structure moléculaire d’un anticorps
• Origine de la diversité des immunoglobulines
• L’interaction de la molécule d’anticorps avec
l’antigène
• Principales propriétés biologiques des Ig

2
Définition: les immunoglobulines (Ig)
•glycoprotéines présentes soit à la surface des lymphocytes B (sIg
est le BCR « B cell receptor »), soit sous forme soluble dans les
liquides biologiques.
• Les deux catégories d’immunoglobulines ont pour fonction essentielle
de se lier de manière spécifique à l’antigène : fonction anticorps.
• Elles sont produites par les lymphocytes B. Un LB donné produit
des Ig avec qu’une seule spécificité anticorps c’est à dire qui ne
reconnaît qu’un seul épitope ou déterminant antigénique
• Le répertoire antigénique des immunoglobulines est extrêmement
diversifié, on estime qu’un organisme adulte contient à un instant
donné environ 1020 molécules d’Ig, dont plus de 109espèces
moléculaires différentes
• Les anticorps sont les médiateurs de l’immunité humorale dont les
cibles sont extracellulaires
Structure de base des
immunoglobulines
•4 chaînes
polypeptidiques
reliées par des
ponts disulfures
(forme de "Y")
– 2 chaînes lourdes
identiques (50kD)
– 2 chaînes légères
identiques (25kD)

3
•Les chaînes lourdes: 5
isotypes ou classes
-µ
µµ
µ:IgM
-δ
δδ
δ:IgD
-γ: IgG, 4 sous-classes
(IgG1, IgG2, IgG3et IgG4)
-α:IgA, 2 sous-classes
(IgA1et IgA2)
-ε:IgE
•Les chaînes légères: : 2
isotypes
-κ(60 % des LB)
-λ(40 % des LB)
Radosavljevic Mirjana
Figure 3-1 part 2 of 3
Organisation des Ig en
domaines:
- Chaînes légères: 1 domaine
Variable et 1 domaine
Constant
-Chaînes lourdes: 1domaine
Variable et 3 ou 4 domaines
Constant
Structure fine des Ig

4
- Les régions V des chaînes
H et L portent un site de
reconnaissance spécifique
de l ’antigène : paratope
- Les régions C portent les
fonctions effectrices de l ’Ig
(fixation du complément,
passage transmembranaire,
fixation aux récepteurs
cellulaires....) ainsi que les
déterminants isotypiques et
allotypiques de l ’anticorps.
Figure 3-3
Clivage de l’Ig
en fragments
fonctionnels
distincts:
-Fab: fragment
de liaison à l’Ag
-Fc: comprend la
partie de l’Ig qui
interagit avec les
cellules
effectrices
-F(ab’)2

5
L’interaction de la molécule d’anticorps
avec l’antigène
• Chaque lymphocyte B circulant porte des
récepteurs antigéniques avec une spécificité
unique.
• Mais la spécificité de chaque lymphocyte est
différente.
• L’ensemble des lymphocytes de l’organisme
porte collectivement des millions de spécificités
de récepteurs antigéniques différentes: on parle
de répertoire de récepteur lymphocytaire
Domaines variables et liaison à l’AgDomaines variables et liaison à l’Ag
• Des séquences hypervariables forment le site de liaison
à l’Ag
- 3 zones hypervariables (HV1, 2 et 3 = CDR1, 2 et 3
(Complementary Determining Regions) ) pour chaque domaine V
-Structure III : les zones HV se trouvent à l'extrémité de la zone V et
forme le site de liaison antigénique
• Entre les segments HV se trouvent les régions
charpentes (Framework Regions) : FR1 à 4 qui
présentent peu de variabilité
• Le site de liaison à l’Ag est constitué par les 3 CDR du
domaine VHet les 3 CDR du domaine VL
• Les régions VHet VLsont différentes pour chaque
BCR/LB
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%