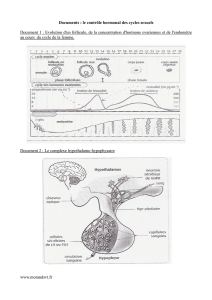
Comment les hormones gycoprotéiques hypophysaures

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
L’
hormone lutéinique (LH), l’hormone
folliculostimulante (FSH) et la thyréosti-
muline (TSH) sont des éléments clés du sys-
tème endocrinien hypothalamo-hypophysaire.
Avec la choriogonadotropine (CG) placen-
taire, elles forment la famille des hormones
glycoprotéiques. Ces hormones sont des
hétérodimères formés de sous-unités αet β,
unies entre elles par des ponts disulfures. La
sous-unité αest identique pour toutes ces
hormones, porte la spécificité d’espèce et a
un poids moléculaire de 22 kDa. La sous-
unité βest, quant à elle, responsable de la
spécificité hormonale et a un poids molécu-
laire de 18-22 kDa.
Les hormones glycoprotéiques hypophy-
saires agissent via des récepteurs membra-
naires. Les récepteurs de la LH et CG (LH-r),
de la FSH (FSH-r) et de la TSH (TSH-r)
sont tous trois des récepteurs couplés aux
protéines G. Les fortes homologies de
séquence entre ces récepteurs définissent la
famille des récepteurs aux hormones glyco-
protéiques (1-3). Ces récepteurs possèdent :
– un domaine N-terminal volumineux qui
constitue le domaine de liaison de l’hormone ;
– un domaine transmembranaire qui traver-
se sept fois la membrane où l’homologie
entre ces récepteurs est la plus grande (envi-
ron 70 %) ;
– un domaine C-terminal intracellulaire
riche en acides amines phosphorylables
(tyrosine, sérine et thréonine).
Les récepteurs aux hormones glycopro-
téiques hypophysaires sont couplés à la pro-
téine Gsα,donc ils stimulent l'adénylate-
cyclase. À forte concentration d’hormones,
ils peuvent également lier la protéine Gq/11
et stimuler la phospholipase C.
Les tissus cibles des gonado-
trophines (LH, FSH)
LH et FSH jouent en association un rôle
majeur dans la sécrétion des hormones sté-
roïdes, d’une part, et dans la production des
gamètes, d’autre part. Leurs cibles princi-
pales sont les gonades (1, 4, 5).
128
Nouveau concept
✎La famille des hormones glycopro-
téiques hypophysaires regroupe l’hor-
mone lutéinique (LH), l’hormone folli-
culostimulante (FSH) et la thyréostimu-
line (TSH). Avec la choriogonadotropine
(CG), elles forment un ensemble de
glycoprotéines homologues. Ces hor-
mones agissent via des récepteurs
membranaires spécifiques : LH-r (pour
la LH et la CG), FSH-r (pour la FSH) et
TSH-r (pour la TSH).
✎Les récepteurs LH-r, FSH-r et TSH-r
constituent un sous-groupe au sein de
la grande famille des récepteurs liés
aux protéines G. Couplés à la protéine
Gs
α
, les récepteurs des hormones gly-
coprotéiques hypophysaires stimulent
l’adénylate-cyclase. Les mêmes récep-
teurs peuvent également stimuler la
phospholipase C, mais à forte concen-
tration d’hormone.
✎La LH et la FSH ont un rôle majeur
dans la production et sécrétion des
hormones stéroïdes et dans la produc-
tion des gamètes. Leurs organes cibles
sont les gonades. La TSH, quant à elle,
a comme cible la thyroïde. Elle contrôle
la synthèse et la libération des hor-
mones T3 et T4 et maintient le phénotype
différencié du thyrocyte.
✎Les hormones glycoprotéiques hypo-
physaires sont sécrétées, de manière
pulsatile, à des concentrations relati-
vement faibles dans le sang. De plus,
un maximum d’activité hormonale
nécessite la disparition rapide de ces
hormones de la circulation.
✎Pour atteindre leurs cellules cibles,
les hormones glycoprotéiques hypo-
physaires doivent franchir rapidement
et spécifiquement la barrière endothé-
liale située au niveau des microvais-
seaux des organes cibles.
✎L’endothélium microvasculaire des
organes cibles exprime des récepteurs
aux hormones glycoprotéiques hypo-
physaires. Ces récepteurs, identiques
à ceux des cellules cibles, sont impli-
qués dans le passage transendothélial
(transcytose) de l’hormone.
✎La transcytose par l’intermédiaire
de récepteurs aux hormones glycopro-
téiques hypophysaires se fait par le
biais des puits et des vésicules recou-
verts de clathrine, ce qui constitue un
mécanisme de transport complètement
différent de celui des protéines
sériques, présentes, elles, en grande
concentration dans le sang. Ce type de
mécanisme de transport n’est pas
observé dans des organes non cibles.
✎Les cellules endothéliales expriment
également des récepteurs spécifiques
pour d’autres hormones peptidiques et
protéiques. La transcytose d'hormone
peut donc constituer un niveau de
régulation hormonale.
✎Les mécanismes moléculaires (motifs
d'internalisation, signaux d'adressage
vers les pôles de l’endothélium, les
protéines associées) impliqués dans le
transport transendothélial par l’inter-
médiaire de récepteurs aux hormones
peptidiques/protéiques restent à définir.
*INSERM U135 “Hormones, gènes et reproduction”, hôpital de Bicêtre, Le Kremlin-Bicêtre.
Comment les hormones glycoprotéiques
hypophysaires franchissent
la barrière endothéliale pour atteindre
leurs cellules cibles
N. Ghinea*

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
Chez la femme, classiquement, la LH se lie
au LH-r localisé sur la membrane plasmique
des cellules de la thèque. Elle contrôle la
sécrétion d’estradiol dans la première partie
du cycle. La FSH se lie au FSH-r localisé
sur la membrane des cellules de la granulo-
sa. Elle contrôle la folliculogenèse. En
seconde partie du cycle, les cellules de la
granulosa du follicule sélectionnées se lutéi-
nisent, le récepteur de la LH y est exprimé
et sa stimulation active la stéroïdogenèse et
la production de progestérone.
Chez l’homme, la LH agit sur son récepteur
exprimé à la surface des cellules de Leydig.
L’activation du récepteur LH-r aboutit à la
production de testostérone. La FSH agit sur
les cellules de Sertoli et joue un rôle majeur
dans la régulation de la spermatogenèse.
Les tissus cibles de la TSH
La TSH est souvent définie comme le prin-
cipal agent régulateur de la thyroïde. Elle
contrôle la principale fonction thyroïdienne
(synthèse et libération des hormones T3 et
T4) et maintient le phénotype différencié du
thyrocyte (synthèse de la thyroglobuline, de
la thyréoperoxydase et de la pompe à iodure).
La présence du TSH-r ou de son ARNm a
également été mise en évidence dans des
tissus non thyroïdiens très variés. Ainsi, on
a pu détecter par PCR, l’ARNm du TSH-r
dans le tissu rétro-orbital, des lymphocytes
circulants, des cardiomyocytes, dans le rein,
les glandes surrénales et le thymus (7). La
présence de la protéine a été confirmée par
immunocytochimie.
Deux processus séparés sont impliqués dans
le mécanisme d'action des hormones glyco-
protéiques hypophysaires :
◗ces hormones doivent impérativement
émigrer de l'espace vasculaire vers le fluide
interstitiel où résident leurs cellules cibles ;
◗successivement, elles doivent se lier à
leurs récepteurs spécifiques et initier une
cascade d'événements intracellulaires.
Si la synthèse, la sécrétion dans l’espace
vasculaire et les interactions des hormones
glycoprotéiques hypophysaires ont été
amplement étudiées (1, 4-6),les étapes
intermédiaires comme, par exemple, le pas-
sage à travers l’endothélium vasculaire, sont
mal connues. Ce dernier constitue une bar-
rière majeure pour les échanges des macro-
molécules entre le sang et les organes ou les
tissus (8).
Nécessité d’un transport trans-
endothélial spécifique pour les
hormones protéiques
Les échanges des substances (métabolites,
hormones, nutriments) entre le sang et les
tissus ont lieu au niveau des capillaires et
des veinules. La paroi de ces microvais-
seaux est réduite à l’endothélium vasculaire.
Situées entre deux fluides différents – le
plasma et le fluide interstitiel –, les cellules
endothéliales sont polarisées. Leur surface
luminale est continuellement exposée aux
cellules sanguines et au plasma. La surface
opposée (surface tissulaire ou abluminale)
est arrosée par le fluide interstitiel. L’endo-
thélium vasculaire est séparé des tissus par
une lame basale que les cellules endothé-
liales produisent elles-mêmes.
Les cellules endothéliales sont unies les
unes aux autres par des jonctions étanches
bien développées, de façon à former la bar-
rière sang/tissus. Cette barrière empêche le
passage de macromolécules hydrosolubles
du sang dans les tissus.
Pour traverser cette barrière, les protéines
sériques (présentes en grande concentration
dans le plasma) utilisent un mécanisme de
transport non spécifique (9) :la diffusion en
phase fluide par l'intermédiaire des vési-
cules plasmalemmales (figure 1).
Néanmoins, ce mécanisme est trop lent
comparé à l’action rapide des hormones
protéiques qui sont, de plus, présentes en
très faible concentration dans le plasma.
D’autres mécanismes doivent donc être
impliqués dans le transport transendothélial
(transcytose) des hormones protéiques.
129
Nouveau concept
Figure 1. Transport transendothélial des protéines sériques : micrographie électronique illustrant le passage
de l’immunoglobuline G couplée à l'or colloïdal de 5 nm. Pour traverser la barrière endothéliale, les protéines
sériques, comme par exemple les immunoglobulines, présentes en grande concentration dans le plasma, utili-
sent un mécanisme de transport non spécifique, en phase fluide, par l’intermédiaire des vésicules lisses.
bl : lame basale, cp : puit recouvert de clathrine, END : endothélium capillaire, is : espace interstitiel,
L : lumière du capillaire, va:vésicule lisse abluminale, vl:vésicule lisse luminale.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
L’endothélium vasculaire
exprime des récepteurs
spécifiques aux hormones
protéiques incluant les hormones
glycoprotéiques hypophysaires
Les résultats des expériences, effectuées
dans différents laboratoires (dont le nôtre)
au cours des 20 dernières années, ont mon-
tré que l’endothélium vasculaire exprime
des récepteurs pour plusieurs hormones pro-
téiques telles que : l’insuline, le glucagon, la
vasopressine, l’ocytocine, l’angiotensine II,
la leptine, la prolactine, la calcitonine et les
gonadotrophines (10, 11). Parmi ces hor-
mones, certaines sont à la fois endocytosées
et transcytosées. C’est le cas de l’insuline
(12). D’autres hormones comme, par
exemple, la leptine (13) et l’hCG (14),tra-
versent la barrière endothéliale sans dégra-
dation apparente. Un transport unidirection-
nel de la lumière des vaisseaux vers le pôle
tissulaire a été rapporté pour la grande
majorité des hormones protéiques. Un trans-
port du pôle tissulaire vers la lumière des
vaisseaux a été décrit pour l'interleukine-8
(15).
À l’exception des gonadotrophines, dont
nous reparlerons, les organites impliqués
dans la transcytose par l’intermédiaire de
récepteurs aux hormones protéiques sont
inconnus. Les mécanismes moléculaires
impliqués dans ce transport transendothélial
(motifs d’internalisation, signaux d’adressa-
ge vers les deux pôles de l’endothélium et
les protéines associées aux récepteurs) res-
tent, eux aussi, inconnus.
Transcytose des gonadotrophines :
organites et mécanismes impliqués
Pour atteindre leurs cellules cibles, les
gonadotrophines doivent traverser la barriè-
re vasculaire des gonades (figure 2). Leur
concentration dans le sérum est faible et
varie de manière pulsatile (11). De plus, les
gonadotrophines contenant de la N-acétyl-
galactosamine-sulfatée seraient rapidement
captées par les cellules non parenchyma-
teuses du foie (le récepteur impliqué étant
distinct des systèmes classiques) (16). Par
ailleurs, un maximum d'activité hormonale
nécessite la disparition rapide des gonado-
trophines de la circulation. Donc, pour ces
hormones, un transport transendothélial
rapide et spécifique est indispensable.
Nous avons étudié par microscopie électro-
nique ce mécanisme (14). Le transfert de
l’hormone radioactive a également été ana-
lysé. Des expériences in situ, en perfusant
des testicules de rat avec de l’or colloïdal
(visible en microscopie électronique) couplé
a l’hCG, nous ont permis de démontrer l’in-
teraction de l’hormone avec un composant
de la surface endothéliale. Nous avons iden-
tifié ce composant par immunocytochimie
ultrastructurale et par immunochimie
comme étant le récepteur de la LH.
La transcytose de l'hCG a lieu en plusieurs
étapes :
1. liaison de l’hormone aux récepteurs spé-
cifiques localisés sur la surface luminale des
cellules endothéliales (artérioles, capillaires,
veinules) ;
2. concentration des complexes hormone-
récepteur (H-r) dans les puits recouverts de
clathrine ;
3. l’internalisation et le transfert du com-
plexe H-r par le biais des vésicules recou-
vertes de clathrine au niveau des endosomes ;
4. transport du complexe H-r vers le pôle
tissulaire via les vésicules lisses bourgeon-
nant à partir des endosomes ; fusion de ces
vésicules avec la membrane plasmique
abluminale ;
5. dissociation du complexe H-r et relargage
de l’hormone dans l’espace interstitiel.
Nous avons récemment mis en évidence une
voie similaire de transcytose pour la FSH
(N. Ghinea, manuscrit soumis pour publica-
tion).
L’hormone et son récepteur
suivent le même trafic
transendothélial
Pour suivre sur les mêmes coupes les voies
de transcytose de l'hormone et de son récep-
teur, nous avons effectué des expériences de
double marquage. Des anticorps monoclo-
naux dirigés contre le récepteur de la LH et
couplés à l’or colloïdal de 5 nm ont été uti-
lisés comme marqueurs directs du récepteur
LH-r. Ils se fixent sur le domaine extracellu-
laire du récepteur et n’interfèrent pas avec
la liaison de l’hormone et l’activation de
l’adénylate-cyclase. Par contre, le devenir
de l’hormone a été suivi en couplant l’hCG
à l’or colloïdal de 15 nm. En perfusant un
mélange de hCG-Au15 nm et LH-r729-Au 5 nm
nous avons observé une colocalisation des
deux traceurs dans les puits recouverts de
130
Nouveau concept
Figure 2. Micrographie électronique illustrant la
barrière sang-testicule et les cellules cibles des
gonadotrophines.
ei : espace interstitiel end : endothélium capillaire
L : lumière du capillaire LC : cellules de Leydig
(cibles de la LH) SC : cellules de Sertoli (cibles de
la FSH)

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
clathrine (figure 3A),les vésicules recou-
vertes de clathrine (figure 3B),les endo-
somes (figure 3C) et les vésicules lisses
voisines du pôle tissulaire (figure 3D). Les
deux marqueurs ont été libérés dans l’espa-
ce interstitiel (figure 3E).
La spécificité de la transcytose
de l’hCG par l’intermédiaire de
récepteurs de la LH
Ce mécanisme de transcytose est spécifique :
le transport transendothélial des traceurs
(hCG-or colloïdal, 125I-hCG) est saturable
car il est inhibé par des concentrations
croissantes d'hormones non marquées. Il est
également dépendant d’énergie. Ce type de
transport est tissu-spécifique : il n’a pas été
observé dans des organes non cibles (graisse
épididymaire, cœur, poumon, diaphragme).
Conclusion
Les hormones glycoprotéiques hypophy-
saires sont sécrétées de manière pulsée en
faibles concentrations dans le sang. Leur
disparition rapide de la circulation sanguine
est nécessaire pour atteindre un maximum
d’activité hormonale. En conséquence, un
transport transendothélial rapide et spéci-
fique est indispensable.
Les études immunocytochimiques et immu-
nochimiques montrent qu’au niveau des
organes cibles (et pas dans les organes non
cibles), les cellules endothéliales des micro-
vaisseaux expriment des récepteurs aux hor-
mones glycoprotéiques hypophysaires. Ces
récepteurs, identiques à ceux des cellules
cibles, lient, concentrent et aident les hor-
mones à traverser rapidement la barrière
endothéliale.
La littérature suggère que ce type de trans-
port transendothélial (transcytose), par l’in-
termédiaire de récepteurs, pourrait avoir une
portée relativement générale pour les hor-
mones peptidiques et protéiques. La trans-
cytose d’hormone peut donc constituer un
niveau de régulation hormonale.
L’analyse de ce mécanisme de transcytose
au niveau moléculaire (motifs d’internalisa-
tion, signaux d’adressage vers le front tissu-
laire, protéines associées) est une priorité.
131
Nouveau concept
Figure 3 (A, B, C, D et E). Comparaison des voies de transcytose de l’hCG et du récepteur de la LH dans l’en-
dothélium capillaire de testicule du rat. Expérience de double marquage avec hCG-Au15 nm et LHR729-Au5 nm.
Les deux traceurs marquent les mêmes organites cellulaires suggérant des voies communes de transcytose pour
l'hormone et le récepteur (flèches).
Cp : puit recouvert de clathrine, cv : vésicule recouverte de clathrine, ei : espace interstitiel, etv : endosomes
tubulo-vésiculaires, L : lumière du capillaire, mp : membrane plasmique, V : vésicule lisse.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
Les mécanismes du trafic cellulaire des hor-
mones protéiques, une fois établis, devraient
nous permettre d’envisager des applications
dans les domaines du ciblage des médica-
ments et de la thérapie génique. En effet, ce
type d’expériences nécessite l’utilisation de
vecteurs capables de délivrer l’agent théra-
peutique d’une manière efficace et sélective
au niveau des organes malades. Ce pourrait
être le cas avec les hormones peptidiques et
les anticorps monoclonaux dirigés contre
leurs récepteurs.
Références
1.
Simoni M, Gromoll J, Nieschlag E. The fol-
licle-stimulating hormone receptor : bio-
chemistry, molecular biology, physiology, and
pathophysiology. Endocrine Rev 1997 ; 18 :
739-73.
2.
Dufau ML. The luteinizing hormone recep-
tor. Annu Rev Physiol 1998 ; 60 : 461-96.
3.
Rapoport B, Chazenbalk GD, Jaume JC,
McLachlan SM. The thyrotropin hormone
receptor : interaction with TSH and autoanti-
bodies. Endocrine Rev 1998 ; 19 : 673-716.
4.
Themmen APN, Huhtaniemi IT. Mutations
of gonadotropins and gonadotropin receptors :
elucidating the physiology and pathophysio-
logy of pituitary-gonadal function. Endocrine
Rev 2000 ; 21 : 551-83.
5.
Howles CM. Role of LH and FSH in ovarian
function. Mol Cell Endocrinol 2000 ; 161 :
25-30.
6.
Plant TM, Marshall GR. The functional
significance of FSH in spermatogenesis and
the control of its secretion in male primates.
Endocrine Rev 2001 ; 22 : 764-86.
7.
Ghinea N, Milgrom E. Cellular trafficking
of thethyrotropin implications for an under-
standing of receptor function. Curr Opin
Endocrinol Diabetes 2000 ; 7 : 265-9.
8.
Simionescu M, Simionescu N. Endothelial
transport of macromolecules : transcytosis
and endocytosis. A look from cell biology.
Cell Biol Rev 1991 ; 25 : 1-80.
9.
Williams SK. Vesicular transport of pro-
teins by capillary endothelium. Ann NY Acad
Sci 1983 ; 416 : 457-67.
10.
Ghinea N, Milgrom E. Transport of pro-
tein hormones through the vascular endothe-
lium. J Endocrinol 1995 ; 145 : 1-9.
11.
Ghinea N, Milgrom E. A new function for
the LH/CG receptor : transcytosis of hormone
across the endothelial barrier in target
organs. Sem Reprod Med 2001 ; 19 : 97-101.
12.
King GL, Johnson SM. Receptor-mediated
transport of insulin across endothelial cells.
Science 1985 ; 227 : 1583-6.
13.
Bjorbaek C et al. Expression of leptin iso-
forms in rat brain microvessels. Endocrinology
1998 ; 139 : 3485-91.
14.
Ghinea N, Vu Hai MT, Groyer-Picard MT,
Milgrom E. How protein hormones reach
their target cells : receptor-mediated transcy-
tosis of hCG through endothelial cells. J Cell
Biol 1994 ; 125 : 87-97.
15.
Middleton J et al. Transcytosis and sur-
face presentation of IL-8 by venular endothe-
lial cells. Cell 1997 ; 91 : 385-95.
16.
Fiete D, Srivastava V, Hindsgaul O,
Baezinger JU. A hepatic reticuloendothelial
cell receptor specific for SO4-4GalNAc
β
1,
4-GlcNAc
β
1,2-Man
α
that mediates rapid
clearance of lutropin. Cell 1997 ; 67 : 1103-10.
132
Nouveau concept
1
/
5
100%