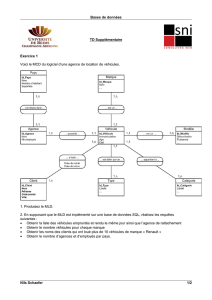
reCHerCHe - Rein

mars -septembre 2012 - Reins-Échos n°12
///
57
reCHerCHe
quentes, de corticodépendance ou
corticorésistance, d’autres traite-
ments immunosuppresseurs sont
utilisés : le mycophénolate, les anti-
calcineurines, le cyclophosphamide
ou un traitement avec un anticorps
anti-CD20 dirigé contre les lympho-
cytes B. Aucun traitement spécifique
de cette maladie n’existe actuelle-
ment et les rechutes sont fréquentes
après l’arrêt ou la diminution de la
corticothérapie. Une corticodépen-
dance, ainsi que des complications
de la corticothérapie et des immuno-
suppresseurs sont observées chez
plus de 60% des patients.
La physiopathologie du SNI demeure
mal connue. C’est pourquoi plusieurs
hypothèses et voies de recherches
sont actuellement explorées. Au
niveau épidémiologique, la prépon-
dérance de la maladie chez le gar-
çon évoquent l’existence d’un terrain
génétique spécifique. Ce déséqui-
libre du sex-ratio dans certaines
populations évoque l’implication
d’un ou de plusieurs gènes portés
par le chromosome X. La distribu-
tion des âges de début de la mala-
die est commune dans la plupart
des études. La très grande majo-
rité des cas surviennent entre 1 et
10 ans avec une incidence 4 ou 5 fois
supérieure dans la tranche d’âge 1-4
ans par rapport à la tranche d’âge
10-15 ans. Par contre, l’existence
de cas groupés chronologiquement
et géographiquement suggère l’in-
tervention d’un agent infectieux ou
environnemental dans le premier
déclenchement de la maladie. Il
existe une simultanéité de l’âge du
début du SNI et des primo-infections
virales (virus Epstein-Barr, cytomé-
galovirus, adénovirus, herpèsvirus),
et des infections bénignes des voies
aériennes supérieures surviennent
fréquemment avant une poussée.
De plus, chez certains patients,
des épisodes d’allergies cutanées
ou respiratoires peuvent précéder
les poussées de SNI. Ces observa-
tions sous-entendent qu’un disfonc-
tionnement des défenses de l’orga-
nisme contre les agents pathogènes
et/ou allergènes pourrait entraîner
un SNI, mais cela reste à démontrer.
Le SNI n’apparaît pas comme une
maladie rénale primaire, mais
comme une pathologie du système
immunitaire dont le rein est la cible
exclusive. L’hypothèse la plus com-
munément admise est la présence
d’un facteur circulant dans le sang
jusqu’à présent non découvert et
responsable de l’augmentation de
la perméabilité de la barrière de fil-
tration glomérulaire. La protéinu-
rie et le SNI réapparaissent chez les
patients transplantés pour cortico-
résistance secondaire. Des rémis-
sions sont obtenues après transfert
de plasma de personnes saines chez
les malades. Bien que les numé-
rations et formules sanguines des
patients SNI soient normales, il
existe des anomalies au niveau des
globules blancs sanguins qui sont
les cellules du système immuni-
taire. Ainsi, les polynucléaires neu-
trophiles sont à l’origine d’un stress
oxydant augmenté jusqu’à 10 fois
chez les enfants atteints de SNI, en
corrélation avec le niveau de pro-
téinurie. Lors des poussées, ainsi
qu’en rémission, les cellules du sys-
tème immunitaire présentes dans le
sang des patients SNI, en particulier
les lymphocytes T, ont une capacité à
se multiplier supérieure comparati-
vement aux mêmes cellules de per-
sonnes saines. Les arguments clas-
siques pour un dysfonctionnement
des lymphocytes T sont la cortico-
sensibilité, les rémissions prolon-
gées après une rougeole, l’associa-
tion particulière avec les tumeurs
du thymus (organe de maturation
des lymphocytes T). Il faut ajouter
que des immunosuppresseurs, tels
que les anticalcineurines, le cyclo-
phosphamide et le mycophénolate
entrainent des rémissions prolon-
gées. L’implication des lymphocytes
B dans le SNI repose sur plusieurs
observations, telles que les rémis-
sions après déplétion des immuno-
globulines plasmatiques (Igs), les
anomalies de d istribution des sous-
classes d’IgG en rémission comme
en rechute, l’inhibition de la produc-
tion d’Igs par le mycophénolate et
l’efficacité des anticorps anti-CD20
pour prévenir les rechutes. Le SNI
est aussi associé à presque tous les
types de leucémie de type B. Il existe
aussi des anomalies de coopération
entre les lymphocytes T et B.
Par ailleurs, deux études récentes
ont permis de montrer que des ano-
malies mécanistiques impliquant
certaines protéines des podocytes
sont à l’origine de la protéinurie. La
protéine c-mip joue un rôle dans la
désorganisation de la structure des
podocytes in vitro et elle est surex-
primée chez les patients atteints
de SNI comparé à des personnes
témoins. La surexpression de l’an-
giopoétine-like-4 par les podocytes
chez le rat peut induire un SNI. Dans
ce modèle animal, il a été montré
que la protéinurie était due à une
hyposialylation de l’angiopoétine-
like-4. La protéinurie était réver-
sible en cas de traitement par l’acide
sialique chez le rat, ce qui pourrait
donc être une molécule potentielle-
ment intéressante pour des traite-
ments du SNI. Il a aussi été montré
une surexpression de l’angiopoé-
tine-like-4 dans les glomérules des
patients SNI, comparé à des per-
sonnes témoins.
Actuellement, les recherches en
cours ont pour ambition d’obtenir
une meilleure compréhension des
mécanismes physiopathologiques
du SNI. Cela pourrait permettre
la mise en évidence de nouveaux
marqueurs du SNI qui pourraient
ensuite être optimisés, afin d’être
utilisés dans des tests de diagnos-
tics plus spécifiques de type géné-
tiques et/ou immunologiques. La
meilleure caractérisation du SNI
devrait permettre ensuite de mieux
cibler des molécules qui pourraient
être utilisées au niveau thérapeu-
tique, afin d’établir de nouveaux
traitements qui soient spécifiques
de cette maladie, contrairement aux
corticoïdes et aux immunosuppres-
seurs utilisés actuellement. \\\
1
/
1
100%