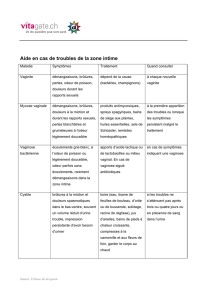
GPC Problèmes vulvo-‐vaginaux chez les femmes attentes de

!
!"#$ "%&'()*+,$ -.(-&/-01230.4$56+7$ (+,$
8+**+,$ 099+39+,$ :+$ -.(-&-012329+$ +9$ :+$
-0123&,+$:03,$(0$;60,+$:+$-2+$%+;%&:.592-+$$
"#$%!&!'()*!+,-.!
/01!2(3%1!45!6()7(1!/5!8%193!:5!/01;%<((*;%!=!
>!70!;%?01;%!;)!@*()A%!;%!8*0<0#7!A()*!7%!;B<%7(AA%?%18!;%$!*%9(??01;08#(1$!;%!
A*%?#C*%!7#@1%!
/%*$#(1!<07#;B%D!E98(F*%!+,-.!
!
!
Contribution)du)patient)et)évaluation)par)le)médecin)généraliste!
Les$guides$de$bonne$pratique$médicale$sont$indicatifs$en$tant$que$soutien$et$constituent$un$point$de$repère$lors$
de$la$prise$de$décisions$diagnostiques$ou$thérapeutiques$en$médecine$générale.$Pour$le$médecin$généraliste,$ils$
résument$la$meilleure$prise$en$charge$d'un$point$de$vue$scientifique$pour$le$patient$moyen.$En$outre,$il$convient$
de$prendre$en$compte$le$contexte$du$patient,$qui$constitue$un$partenaire$équivalent$lors$de$la$prise$de$décisions.$
C'est$pourquoi$le$médecin$généraliste$clarifie$la$demande$du$patient$par$une$communication$adaptée$et$
l'informe$sur$tous$les$aspects$des$éventuelles$options$thérapeutiques.$Il$peut$donc$ arriver$que$le$médecin$
généraliste$et$le$patient$fassent$ensemble$un$meilleur$choix$autre$de$manière$responsable$et$raisonnée.$Pour$
des$raisons$pratiques,$ce$principe$n'est$pas$chaque$fois$soulevé$dans$les$guides$de$bonne$pratique,$mais$est$
mentionné$ici$de$manière$explicite.!

<0'(+$:+,$*092)%+,$
=><?@AB#<=@> 4
OBJECTIF DU GUIDE DE PRATIQUE CLINIQUE 4
CONTEXTE/MOTIVATION 5
POPULATION DE PATIENTS 5
NOTIONS 6
ÉTIOLOGIE 7
CD$EF#G$H$IBGJK$"?@LJMNGKOK=!>GK$G<$KPN"<QNGK$#@>R=G></=J$ASG>R=KF!G?$B>G$
RBJR@RF!=>=<GORF!=>@KG$T 8
RECOMMENDATION 8
ARGUMENTAIRE : 9
RÉFÉRENCES 10
2. QUEL EXAMEN CLINIQUE EN CAS DE SOUPÇON DE VULVOVAGINITE/VAGINOSE ? 11
RECOMMENDATION 11
EXPLICATIONS 11
ARGUMENTAIRE 11
RÉFÉRENCES 12
3. QUELLE STRATÉGIE D’EXAMEN (TESTS SPÉCIFIQUES, DIAGNOSTIC COMPLÉMENTAIRE)
EN CAS DE PROBLÈMES VULVO-VAGINAUX ET DE SOUPÇON CLINIQUE DE VULVO-
VAGINITE/VAGINOSE ? 13
RECOMMENDATION 13
EXPLICATIONS 13
DIAGNOSTIC DE CANDIDOSE VULVO-VAGINALE 14
DIAGNOSTIC DE VAGINOSE BACTÉRIENNE 14
DIAGNOSTIC DE VAGINITE À TRICHOMONAS 15
DIAGNOSTIC D’AUTRES CAUSES DE PROBLÈMES VULVO-VAGINAUX 15
ARGUMENTAIRE 16
RÉFÉRENCES 17
4.QUEL TRAITEMENT EN CAS DE VULVOVAGINITE À CANDIDA ? 19
RECOMMENDATION 19
EXPLICATIONS 19
LE TRAITEMENT MEDICAMENTEUX 19
L’INFECTION RÉCIDIVANTE 20
ARGUMENTAIRE 22
RÉFÉRENCES 23
5. QUEL TRAITEMENT EN CAS DE VAGINOSE BACTÉRIENNE ? 24
RECOMMENDATION 24
EXPLICATIONS 24
ARGUMENTAIRE 25

RÉFÉRENCES 26
6. QUEL TRAITEMENT EN CAS DE VAGINITE À TRICHOMONAS ? 28
RECOMMENDATION 28
EXPLICATIONS 28
ARGUMENTAIRE 28
RÉFÉRENCES 28
7. QUEL TRAITEMENT POUR LES FEMMES QUI PRÉSENTENT DES PROBLÈMES DE
VULVOVAGINITE/VAGINOSE PENDANT LA GROSSESSE ? 30
RECOMMENDATION 30
EXPLICATIONS 30
CANDIDOSE VULVO-VAGINALE 30
VAGINOSE BACTÉRIENNE 30
VAGINITE À TRICHOMONAS 31
ARGUMENTAIRE 31
CANDIDOSE VULVO-VAGINALE 31
VAGINOSE BACTÉRIENNE 31
VAGINITE À TRICHOMONAS 32
RÉFÉRENCES 33
8. CHEZ QUI, COMMENT ET QUAND DÉPISTER UNE VULVOVAGINITE/VAGINOSE
PENDANT LA GROSSESSE ? 35
RECOMMENDATION 35
EXPLICATIONS 35
ARGUMENTAIRE 35
RÉFÉRENCES 36
AGENDA DE RECHERCHE 36
ÉLABORATION 37
AUTEURS 37
MÉTHODOLOGIE ET RECHERCHE DOCUMENTAIRE 37
GRADES DE RECOMMANDATION (GRADE) 38
INTERVENTION DES EXPERTS 39
VALIDATION 40
CONFLIT D’INTÉRÊTS ET FINANCEMENT 40
MISE À JOUR 40
!
$
$
$ $

:18*(;)98#(1!!
G%$!A*(F7C?%$! <0@#10)H! I(*?%18!)1!;%$!A*(F7C?%$!7%$!A7)$! I*BJ)%18$! ;01$! 70! A*08#J)%!
J)(8#;#%11%! ;%!?B;%9#1%! @B1B*07%K!!:7$! $)*<#%11%18!&!)1%!I*BJ)%19%!;L%1<#*(1!-M! 90$! A0*!
-,,,!I%??%$!A0*!01!-!N9O#II*%$!;L:18%@(PK!!
G%$! #1I%98#(1$! <0@#107%$! J)#! 0**#<%18! %1!;%)H#C?%! A($#8#(1! %1! 8%*?%$! ;%!I*BJ)%19%!$(18!
9%77%$! (990$#(11B%$! A0*! Candida$ albicans!%8! ;L0)8*%$! #1I%98#(1$! &! 7%<)*%$!()! #1I%98#(1$!
I(1@#J)%$!N+QRSS!TP! 0#1$#! J)%!70! <0@#1($%! F098B*#%11%! N-URVW!TPK! XL0)8*%$! A08O(@C1%$5!
9(??%!Trichomonas$ vaginalis!%8!Chlamydia$ trachomatis5! $(18!#$(7B$!9O%Y!)1%! ?#1(*#8B!
$%)7%?%18!;%$!I%??%$!J)#!A*B$%18%18!;%$!A*(F7C?%$!<)7<(R<0@#10)HK!Z%7(1!7%$!%$8#?08#(1$5!
9O%Y!Q!T!;%$!I%??%$!088%#18%$!;%!<0@#1#8%!&!901;#;05!#7!$L0@#8!;L)1%!#1I%98#(1!*B9#;#<018%K![1!
90$! ;%! <0@#1($%! F098B*#%11%5! 7%!*#$J)%!;%!*B9#;#<%!%$8!A7)$! #?A(*80185! %1<#*(1!S,!T!;%$!
I%??%$! 088%#18%$! ;%! <0@#1($%! F098B*#%11%! A*B$%18018! )1%!*B9#;#<%!+K!
4%1;018! 70!@*($$%$$%5!#7!%$8! B@07%?%18! A($$#F7%!;%! 9(18*098%*! ;%$! #1I%98#(1$! <0@#107%$5!
$)*8()8!0<%9!)1%!9O0*@%!$)F'%98#<%!%8!)1!%II%8!B<%18)%7!$)*!70!A()*$)#8%!;%!70!@*($$%$$%K!40*!
0#77%)*$5!8()$! 7%$!A*(F7C?%$!<)7<(R<0@#10)H!1%!$(18!A0$!;L(*#@#1%!#1I%98#%)$%!%8!#7!9(1<#%18!
;(19!B@07%?%18!;L%1<#$0@%*!;L0)8*%$!;#0@1($8#9$K!!
!
Objectif du guide de pratique clinique
\%!@)#;%!;%!A*08#J)%!97#1#J)%!<#$%!&!I(*?)7%*!;%$!*%9(??01;08#(1$!*%708#<%$!0)!;#0@1($8#9!
%8!0)!8*0#8%?%18!;%!70!<)7<(<0@#1#8%!%8!;%!70!<0@#1($%!9O%Y!70!I%??%!;01$!70!AO0$%!;%!<#%!
*%A*(;)98#<%!N-Q!&!QQ!01$PK!]()$!9#F7(1$!7%$!I%??%$!J)#!9(1$)78%18!7%)*!?B;%9#1!A()*!;%$!
A*(F7C?%$!<)7<(R<0@#10)HK!\%!@)#;%!;%!F(11%!A*08#J)%!$%!7#?#8%!0)H!;#0@1($8#9$!;%!<0@#1#8%!
%8!;%! <0@#1($%5! 8()8! %1! A(*8018! )1%! 088%18#(1! $AB9#I#J)%! 0)H! #1I%98#(1$! <0@#107%$! 7%$!A7)$!
I*BJ)%18%$!D!\01;#;0!07F#901$5!70!<0@#1($%!F098B*#%11%!%8!^*#9O(?(10$!<0@#107#$K!:7!#?A(*8%!
;L%H97)*%! B@07%?%18! ;L0)8*%$! #1I%98#(1$5! 1(80??%18! 7%$! #1I%98#(1$! $%H)%77%?%18!
8*01$?#$$#F7%$!N:Z^PK!G%!8*0#8%?%18!;%$!:Z^!A0*!9(18*%!1%!I0#8!A0$!7L(F'%8!;%!9%!@)#;%!;%!F(11%!
A*08#J)%K! ]()$! 1L0AA*(I(1;#*(1$! A0$! 1(1!A7)$!70! 8OB?08#J)%! ;)! 8*0#8%?%18! ;%$! #1I%98#(1$!
<0@#107%$! 9O%Y!7%$!I%??%$! A(*8%)$%$! ;)! /:_5! %1! 90$! ;L)8#7#$08#(1! ;L#??)1($)AA*%$$%)*$!
A()*! 0II%98#(1! *O)?08#$?07%! ()! 0A*C$! )1%!@*%II%K!>!9%$! B@0*;$5! #7!9(1<#%18! ;L(*#%18%*! 70!
A08#%18%! <%*$!)1!@31B9(7(@)%K!X%$! *%9(??01;08#(1$! $(18! B@07%?%18! I(*?)7B%$! ;01$! 9%!
;(9)?%18! J)018! 0)! ;#0@1($8#9! %8! &! 7L0AA*(9O%! ;%!70! <)7<(<0@#1#8%`<0@#1($%! A%1;018! 70!
@*($$%$$%K!G%!@*()A%!9#F7B! A0*! 9%!@)#;%!;%!F(11%! A*08#J)%! %$8!9%7)#!;%$!?B;%9#1$!
@B1B*07#$8%$5!(F$8B8*#9#%1$5!AO0*?09#%1$! %8!0)8*%$! A*(I%$$#(11%7$!;%!70!$018B!;01$! 7%!90;*%!
;%$!$(#1$!;%!$018B!;%!A*%?#C*%!7#@1%K!!
!
1!"#$%&'(#)'!*+!,#)#&%-!$&%.'/.#0!12!3#45#)6!7)'#,*8$&*9#.'6!:;)-/)#<6!=>??!:./'#@!=>?A!>A!?B<C!D5%/-%E-#!
+&*(F!2G3FH''$FIIJJJ6/)'#,*6E#
2!5%)!@#!3/K@*)L!MN!#'!%-6!O/#L'#)!/)!@#!H4/K%&'K$&%L'/9L6!P$&/),#&!Q#@/%!!=>??

Contexte/motivation
G%!A*B9B;%18!@)#;%!;%! A*08#J)%! 97#1#J)%! *%708#I! &! 70! <0@#1#8%! %8!70! <0@#1($%! N;%!X(?)$!
"%;#905!019#%11%?%18!a<<_!ba%8%1$9O0AA%7#'c%!<%*%1#@#1@!<((*!_)#$0*8$%1d!D!7L0$$(9#08#(1!
$9#%18#I#J)%! I70?01;%! ;%!?B;%9#1%! @B1B*07%P! ;08%! ;%!+,,+5!;%!1()<%77%$!;(11B%$!
$9#%18#I#J)%$! 9(19%*1018! 7L0AA*(9O%! ;%!70! <0@#1#8%`<0@#1($%! (18!*%1;)! 9%88%! ?#$%!&!'()*!
1B9%$$0#*%K!
!
Population de patients
\%!@)#;%!;%!F(11%!A*08#J)%!$L0AA7#J)%!0)H!I%??%$!;01$!7%)*!AO0$%!;%!<#%!*%A*(;)98#<%!N-Q!
&! QQ! 01$P! 0#1$#! J)L0)H! I%??%$! %19%#18%$! 9(1$)78018! 7%)*!?B;%9#1!A()*!;%$!A*(F7C?%$!
B<%18)%77%?%18! 7#B$!&!)1%! <0@#1#8%K! e)9)1%! *%9(??01;08#(1! 1L%$8! 0AA(*8B%! ;01$! 9%!
;(9)?%18!%1!*0AA(*8!0<%9!7%!8*0#8%?%18!9O%Y!7L%1I018!()!%1!*0AA(*8!0<%9!7L0AA*(9O%!;%!70!
<0@#1#8%!A%1;018!70!?B1(A0)$%K!!
!
!!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%