Télécharger la brève (PDF- 540 Ko)

Actualités scientiques
Institut écologie et environnement
CNRS - Campus Gérard Mégie
3 rue Michel-Ange, 75794 Paris Cedex 16
T 01 44 96 43 08
com-inee@cnrs-dir.fr
www.cnrs.fr/inee
www.cnrs.fr
Institut écologie et environnement
IroT/mavN, a new iron-regulated gene involved in Legionella
pneumophila virulence against amoebae and macrophages, par
Emilie Portier, Huaixin Zheng, Tobias Sahr, Denise M. Burnside, Celeste
Mallama, Carmen Buchrieser, Nicholas P. Cianciotto and Yann Héchard
publié dans Environmental Microbiology le 15 septembre 2014
En savoir plus
Yann HÉCHARD,
Mél : [email protected]
Contacts chercheurs
Ecologie et biologie des interactions (EBI), Université de Poitiers - Bât.
B8-B35 1er étage - 40 Av du Recteur Pineau-TSA51106 - 86073 POITIERS
CEDEX 9
Informations complémentaires
Comment la bactérie de la légionellose
détourne le fer de ses hôtes ?
Octobre 2014
C’est indéniable : Legionella pneumophila, la bactérie
responsable de la légionellose a besoin de fer pour se multiplier
et infecter ses hôtes. Grâce à une étude transcriptomique, des
chercheurs du Laboratoire Ecologie et Biologie des Interactions
(EBI), en collaboration avec des équipes de l’Institut Pasteur et de
l’Université de Chicago, ont identié un nouveau gène essentiel
à la capture du fer et donc à la multiplication de la bactérie
Legionella chez son hôte. Les résultats de ces travaux ont été
publiés dans la revue Environmental Microbiology.
La bactérie Legionella pneumophila s’inltre chez l’homme par les
voies respiratoires et colonise un type de cellules bien particulier : les
macrophages pulmonaires. La plupart du temps, la bactérie est détruite
par ces cellules du système immunitaire programmées pour digérer les
intrus. Mais parfois, la bactérie résiste à la phagocytose et peut alors
déclencher une maladie pulmonaire connue sous le nom de légionellose.
La résistance a été acquise, au l du temps, dans son environnement
naturel, en infectant des amibes(1) très similaires aux macrophages
humains. « Cette capacité de résistance à la phagocytose n’est pas le seul
problème, souligne Yann Héchard, microbiologiste au Laboratoire Ecologie
et Biologie des Interactions du CNRS. Comme l’ont montré nos collègues
de l’Université de Chicago, si la bactérie résistante est capable de capter
du fer à l’intérieur de la cellule, elle va pouvoir se nourrir, se multiplier et
là, devenir vraiment dangereuse ».
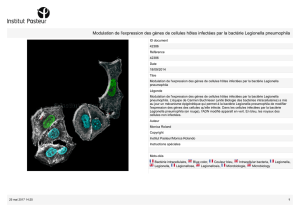
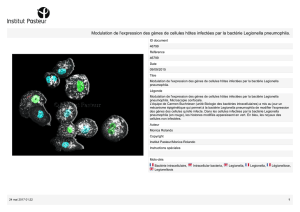
An de déterminer quels sont les gènes bactériens impliqués dans
la capture du fer, les chercheurs ont décidé de réaliser une étude
transcriptomique, autrement dit une étude de l’expression des gènes de
l’ensemble du génome de la bactérie. Concrètement, ils ont cultivé L.
pneumophila dans un milieu carencé en fer puis ont analysé le niveau
d’expression des 3.000 gènes de la bactérie. Grâce à des marqueurs
uorescents, les gènes les plus actifs – c’est-à-dire les gènes
naturellement impliqués dans la capture du fer - ont pu être identiés.
«Un nouveau gène s’est vraiment détaché du lot, raconte Yann Héchard.
Sans lui, la bactérie est incapable de puiser du fer chez son hôte et
de se multiplier. Autrement dit, nous avons montré que ce gène était
responsable de la capture du fer dans la cellule hôte ». Des résultats qui
offrent de nouvelles pistes pour prévenir la transmission des bactéries,
véhiculées par de nes gouttelettes d’eau, mais aussi pour améliorer les
traitements. « On peut imaginer limiter la multiplication des légionelles en
diminuant la concentration en fer dans les réseaux d’eau, par exemple,
mais aussi grâce à des médicaments capables de limiter la disponibilité
en fer ou la capture du fer par les bactéries chez les patients infectés »,
conclut Yann Héchard.
Une bactérie et une amibe
(© Marie-Hélène Rodier.)
1
/
1
100%