Angiogenèse tumorale dans un modèle de mélanome

Angiogenèse tumorale dans un modèle de mélanome
Pauline Hämmerli, Lycée Denis-de-Rougemont, Neuchâtel
Marie-Michelle Manga, Gymnase français, Bienne
Supervision : Olivier Dubey, EPFL
Introduction
Le mélanome est un cancer de la peau très
agressif qui apparaît lorsque les mélanocytes,
cellules localisées dans l’épiderme,
contractent trop de mutations génétiques.
L’importance des mélanocytes réside dans le
fait qu’elles sont les cellules qui nous
protègent contre les rayons UV du soleil
grâce à la mélanine qu’elles contiennent et
produisent au sein de petites vésicules
appelées mélanosomes. La mélanine est une
molécule capable d’absorber le surplus de
rayons UV lorsque nous sommes exposés
trop longtemps au soleil.
L’angiogenèse, est un processus à la fois
physiologique et pathologique, à travers lequel
la formation de nouveaux vaisseaux sanguins
est rendue possible, à partir de vaisseaux
sanguins préexistants. Comme toutes les
cellules saines de notre corps, les cellules
cancéreuses ont besoin d’un apport de
nutriments et d’oxygène afin de produire
l’énergie dont elles ont besoin pour survivre et
continuer à se développer. Le transport de ces
éléments étant assuré par les vaisseaux
sanguins, les cellules tumorales doivent donc
être capables de procéder à l’angiogenèse.
L’activin-A est une protéine de la famille des facteurs de croissance transformant (TGF-ß transforming
growth factor en anglais). Les TGF-ß ont énormément de rôles physiologiques dont un étant d’inhiber la
croissance cellulaire lorsque cela est nécessaire ; et théoriquement, si la croissance cellulaire n’a pas lieu,
les cellules cancéreuses ne peuvent pas se diviser. Ces TGF-ß sont donc des voies de signalisation
suppresseur de tumeur mais seulement au début de la progression cancéreuse. Après un certain nombre
d’études les chercheurs ont découvert qu’INHBA, le gène codant de la protéine activin-A était surexprimé
dans certains mélanomes. Le rôle de l’activin-A en tant que suppresseur de tumeur devient paradoxal.

Pour essayer de déterminer le rôle exact de l’activin-A, d’autres expériences ont été menées à bien ; Dans la
première, une lignée cellulaire de mélanome humain a été injecté dans une souris dépourvue de son système
immunitaire afin d’éviter le rejet des cellules cancéreuses. En réalité deux types cellulaires ont été injectés,
le premier ; sans surexpression d’act-A, aussi appelée tumeur GFP et le deuxième avec surexpression d’act-
A. A la surprise générale, aucune différence dans le développement n’a été observée entre les deux types
cellulaires (les deux tumeurs ont grandi à la même vitesse et aucune des deux n’a métastasé). Ces résultats
ont mené les chercheurs à se demander s’il n’y avait pas un problème au sein de la voie de signalisation ; ils
ont alors procédé à une autre expérience qui a confirmé que la signalisation fonctionnait tout à fait et que
le problème ne venait pas de là. Pour finir, les chercheurs ont pu en déduire que le rôle de l’act-A n’était pas
de nature autocrine (elle ne réactive pas ces propres récepteurs). Ils en sont venus à se demander si le
système immunitaire n’était pas en cause car l’un des rôles de TGF-ß est de réguler le système immunitaire.
Pour le vérifier, ils ont procédé à la deuxième expérience, sur les mêmes bases que la première mais à la
seule différence que la souris avait pu conserver son système immunitaire (ce qui les a aussi contraints à
utiliser des tumeurs de souris et non des
tumeurs humaines). Les observations ont
montré que la tumeur sans act-A s’est
développée normalement et n’a pas formé de
métastases. Par contre, la tumeur avec act-A a
été beaucoup plus agressive. Elle s’est
développée beaucoup plus vite (tumeur plus
grosse) et a en plus formé des métastases. Les
chercheurs en ont donc conclut que le système
immunitaire était en cause et que l’act-A, en
interagissant avec celui-ci, contribuait
indirectement à la croissance tumorale. Elle a
donc une fonction exocrine. Aujourd’hui on sait
que c’est par le recrutement de certaines
cellules du système immunitaire, qui elles vont
faire grandir la tumeur plus rapidement que
l’act-A exerce son rôle de signalisation exocrine.
Le but de l’expérience à laquelle nous avons participé, était de déterminer si la présence de la protéine
Activin-A a une influence sur le développement des vaisseaux sanguins d’un mélanome.
Méthodes
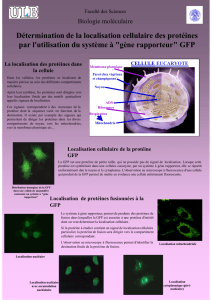
Le western blot est une technique utilisée pour détecter la
présence de protéines spécifiques dans un échantillon de tissu.
Nous avons personnellement utilisé cette méthode afin de vérifier
la présence d’activin-A dans les échantillons de tumeur que nous
voulions étudier.
La première étape pour un Western Blot, est la préparation des
échantillons de tumeur avec activin-A et sans activin-A (GFP) afin
de procéder à l’électrophorèse. Pour ce faire, nous avons d’abord
procédé à leur dilution afin d’assurer la même concentration de
protéines dans chaque échantillon. Et pour finir nous avons attribué
une charge électronique négative aux protéines en ajoutant une
solution de SDS dans chaque échantillon (tampon Laemmli).
Echantillons des protéines disposés dans les
puits
Gel en cours de polymérisation (avec moule à
puits au-dessus

Nous avons commencé par mélanger un certain nombre de substances, la principale étant l’acrylamide
polymérisé, afin de constituer un stacking gel et un running gel. Les deux forment ensemble le support de
migration des protéines. Le running gel est coulé en premier et représente environ les 3/4 du gel. C’est lui
qui permet la séparation des protéines lors de l’électrophorèse. Le stacking gel quant à lui, est coulé au-
dessus du running gel. Il est responsable du maintien des protéines au même niveau, lors de leur disposition
dans les puits, afin que l’électrophorèse commence de manière homogène. Une fois que les deux gels ont
été coulés dans le gel cassette et que le moule à puits a été disposé au-dessus du système, il ne reste plus
qu’à attendre que le gel polymérise.
Une fois que le gel a polymérisé, on verse tout autour du gel cassette, une solution tampon. Ensuite on
enlève le moule à puits et on dispose les échantillons
contenants les protéines tumorales dans les puits. (un
échantillon par puits). Pour démarrer l’électrophorèse, il
faut simplement brancher le gel caster à un générateur de
manière à ce que la charge positive se trouve à l’opposé des
puits ; c’est-à-dire au pied du gel. La charge positive attirant
les protéines chargées négativement, celles-ci vont migrer
vers le bas. Chaque protéine a sa propre taille et son propre
poids et lors d’une électrophorèse, les protéines les plus
légères migrent plus rapidement. C’est de cette manière
que leur séparation se fait. L’unité de mesure utilisée pour
le poids des protéines est le kDa (kilo dalton).
Après l’électrophorèse, nous avons procédé à une manipulation
nous permettant de transférer les protéines sur une membrane
organique. A l’aide d’un générateur, la membrane se charge
positivement. La charge
positive attirant les
protéines chargées
négativement, celles-ci
vont migrer sur la
membrane. Ce transfert
permet de rendre les
protéines accessibles aux anticorps qui leur sont spécifiques. Sur la
membrane, les protéines se trouvent exactement au même endroit
qu’après leur migration sur le gel.
Dans un premier temps, nous déposons des anticorps primaires sur la membrane qui vont se lier à leur
protéine spécifique. Nous procédons à un lavage afin d'éliminer les anticorps primaires qui n’ont pas pu se
lier à des protéines. Dans un deuxième temps, nous déposons des anticorps secondaires spécifiques aux
anticorps primaires ainsi que dotés d’un fluorophore. Nous procédons de nouveau à un lavage. Et finalement
nous faisons développer les résultats sur des films, dans une chambre noire pour pouvoir analyser les
résultats.
Avant de procéder à l’immunofluorescence, nous avons préparé des coupes de tumeurs que nous voulions
observer grâce à une machine à cryosection (Des coupes de tumeur GFP et des coupes de tumeur Activin-
A).
Migration sur le gel terminée, (preuve :
ligne horizontale bleue tout en bas)
Transfert sur membrane en cours de
préparation
Electrophorèse sur gel en cours

L’immunofluorescence est une méthode de marquage qui permet
de mettre en évidence à travers un microscope des cellules ou des
tissus particuliers en les rendant fluorescents. Cette méthode tire
profit de la spécificité d’un anticorps à un antigène. Notre but étant
de mettre en évidence les vaisseaux sanguins tumoraux, nous
avons déposé un premier anticorps spécifique à la protéine CD31
(= présente sur les cellules endothéliales des vaisseaux sanguins).
Ensuite nous avons déposé un second anticorps spécifique au
premier et doté d’un fluorophore. La protéine GFP est fluorescente
par elle-même, un marquage n’était donc pas nécessaire pour
observer les cellules tumorales.
La microscopie à immunofluorescence confocale consiste à stimuler les fluorphores présents dans la coupe
de tumeur avec un laser de longueur d’onde définie. La longueur d’onde sera d’abord absorbée et ensuite
relâchée par un fluorophore dans une longueur d’onde plus grande (énergie plus faible). Cette longueur
d’onde émise peut être détectée et traduite sous forme de couleur par le microscope. Chaque couleur met
en évidence la présence d’une protéine particulière, car chaque couleur correspond à un fluorophore
spécifique étant lié à un anticorps spécifique à une protéine. Ainsi, on peut facilement mettre en évidence
des tissus. La particularité d’un microscope confocal par rapport à un microscope à immunofluorescence
ordinaire est qu’il comporte un plan focal beaucoup plus mince, permettant des observations plus précises
et de meilleure qualité.
Résultats
Le Western Blot confirme que les tumeurs act-A contenaient bien de l’activin-A et que les tumeurs GFP n’en
contenaient pas. On peut s’en apercevoir en observant la ligne correspondant à la protéine act-A, sa taille
attendue étant 24 kDa. On remarque alors que du côté des tumeurs GFP aucune ligne noire n’est visible. Il
n’y avait donc pas d’act-A dans ces tumeurs. Par contre, du côté des tumeurs act-A, on peut clairement
observer trois lignes noires qui nous indiquent que ces tumeurs contenaient effectivement de l’act-A. Ces
colorations noires sont dues au fait que les récepteurs de l’act-A se sont agglutinés à ces endroits à cause de
sa présence à. Les résultats du western blot confirment aussi les différences notables entres les images des
tumeurs GFP et act-A, obtenues lors de la microscopie confocale.
Les photos prises lors de l’observation des coupes de tumeurs en microscopie immunofluorescente
démontrent que les tumeurs GFP (A, C) contiennent beaucoup plus de vaisseaux sanguins que les tumeurs
act-A (B, D), où ceux-ci sont difficilement détectables. On peut faire la différence grâce à la protéine CD31
présente dans les cellules épithéliales des vaisseaux sanguins. Celle-ci est mise en évidence en vert et cette
couleur est plus abondante sur les images A et C que B et D.
Il faut noter que les vaisseaux sanguins des tumeurs avec GFP sont entremêlés de façon spéciale et ne sont
pas organisées de façon hiérarchique, ce qui est typique des vaisseaux sanguins tumoraux.
La couleur rouge met en évidence la présence de GFP, une protéine présente dans les cellules tumorales.
Protéines des
tumeurs GFP :
absence de la
protéine Activin-A
Protéines des
tumeurs Activin-A :
présence de la
protéine Activin-A

Les quatre images contiennent du rouge car elles représentent toutes des coupes de tumeurs. Ceci nous
permet de délimiter la tumeur et savoir si on observe quelque chose se trouvant à l’intérieur ou à l’extérieur
de celle-ci. Sur les photos C et D, nous nous situons à la limite de la tumeur définie par le trait-tillé bleu. La
partie noire est donc la partie à l’extérieur de la tumeur et la rouge à l’intérieur. On constate que le nombre
de vaisseaux sanguins et plus important à l’extérieur de la tumeur qu’en son centre. Leur densité importante
à l’extérieur de la tumeur est due au fait qu’il est plus difficile pour les vaisseaux sanguins d’atteindre le cœur
de la tumeur en raison du chemin à parcourir.
On observe également une différence quant à la répartition de la protéine GFP dans les cellules tumorales.
Elle est répartie de façon homogène dans les tumeurs GFP (A, C) alors que dans la tumeur act-A (B, D) on
observe une agglutination près de la membrane plasmique des cellules.
A
B
C
D
Les zones rouges mettent en évidence la présence de la protéine GFP dans les cellules tumorales
Les zones vertes mettent en évidence la présence de la protéine CD31 dans les cellules épithéliales des vaisseaux
sanguins
Le trait bleu désigne la limite entre l’intérieur et l’extérieur de la tumeur
Tumeur avec activin-A
Tumeur avec activin-A
Tumeur GFP (sans activin-A)
Tumeur GFP (sans activin-A)
 6
6
1
/
6
100%