Amyloïdoses systémiques

943
CURRICULUM
Amyloïdoses systémiques
Philipp J. Raucha, Beat Müllhauptb, Luc Biedermannb, Markus G. Manza, Frank Ruschitzkac, Andreas Flammerc,
Stephan Segererd, Nilufar Mohebbid, Hans H. Junge, Holger Mochf, Kristian Ikenbergf, Adriano Aguzzig, Mario
Nuvoloneg, Oliver Distlerh, Anita Rauchi, Thomas Fehrj, Bernhard Gerbera
Introduction
Pathogenèse
Diagnostic
Quintessence
Forum Med Suisse 2014;14(50):943–948

CURRICULUM
Forum Med Suisse 2014;14(50):943–948 944
Manifestations cliniques
Stratégies thérapeutiques
Amyloïdose AL
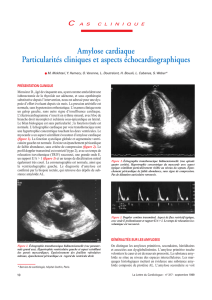
Figure 1
A
B
C
D
AB
CD
Ta bleau 1
FormeProtéine HéréditaireManifestation principale
(% patients)
Tr aitement Remarques
α
β

CURRICULUM
Forum Med Suisse 2014;14(50):943–948 945
L’ atteinte cardiaque détermine l’évolution clinique
Tr aitement
Figure 2:
A
B
C
A
C
B
Ta bleau 2

CURRICULUM
Forum Med Suisse 2014;14(50):943–948 946
Amyloïdose AA
Les reins sont des cibles privilégiées
Maladies inammatoires chroniques et maladies
congénitales
Thérapie: le traitement de la maladie de base
Ta bleau 3
Nombre de critères Stade Part du collectif global Survie médiane
Ta bleau 4

CURRICULUM
Forum Med Suisse 2014;14(50):943–948 947
Amyloïdoses héréditaires
Amylose ATTR
Figure 3:
A
B
C
AB
C
 6
6
1
/
6
100%