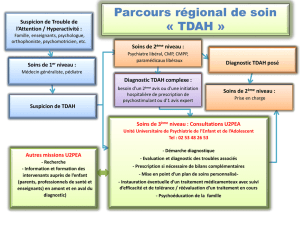
Trouble déficitaire de l`attention avec hyperactivité : état actuel des

Trouble d´eficitaire de l’attention avec hyperactivit´e :
´etat actuel des connaissances et projet de
d´eveloppement d’un agoniste 5-HT1A
Laurie Ragu´e
To cite this version:
Laurie Ragu´e. Trouble d´eficitaire de l’attention avec hyperactivit´e : ´etat actuel des connais-
sances et projet de d´eveloppement d’un agoniste 5-HT1A. Sciences pharmaceutiques. 2010.
<dumas-01021618>
HAL Id: dumas-01021618
https://dumas.ccsd.cnrs.fr/dumas-01021618
Submitted on 9 Jul 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.

AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SICD1 de Grenoble : thesebum@ujf-grenoble.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
http://www.culture.gouv.fr/culture/infos-pratiques/droits/protection.htm

B.U.
M.
GRENOBLE
D
Ill
llllJJlll,1
JlllJJjl
If
li
1111
UNIVERSITE JOSEPH FOURIER
FACULTE
DE
PHARMACIE
DE
GRENOBLE
Année: 2010
Thèse
N°
[ 1 O
lJ
~]
Trouble Déficitaire de !'Attention avec Hyperactivité : état actuel des
connaissances et projet de développement d'un agoniste 5-HT1A
THESE
PRESENTEE
POUR
L'OBTENTION
DU
TITRE DE
DOCTEUR
EN
PHARMACIE
DIPLÔME
D'ETAT
Laurie RAGUE
Née le
21
Juin 1986 à Orsay
THESE SOUTENUE PUBLIQUEMENT A
LA
FACULTE DE PHARMACIE DE GRENOBLE
Le 7 Juillet 2010
DEVANT LE JURY COMPOSE DE
Pr.
D.
WOUESSIDJEWE, Université J. Fourier Grenoble 1 - Président du
jury
Dr. M. GERMAN, Université Paris
Sud-
Directeur de thèse
Pr.
P.
BAC, Université Paris Sud

RESUME
L'hyperactivité est un terme
«grand
public»
associé à une pathologie, le trouble déficitaire
de l'attention avec hyperactivité (TDAH), qui apparaît au cours de l'enfance mais persiste
dans la plupart des cas à
l'âge
adulte. La plupart des traitements développés ciblent l'enfant,
mais
un
besoin existe également chez l'adulte, chez qui la pathologie est encore peu
reconnue.
Comme toute pathologie psychiatrique, le TDAH est complexe, tant dans son diagnostic que
dans sa prise en charge. Depuis longtemps, l'utilité
d'un
traitement médicamenteux dans les
cas avérés de TDAH a été démontrée. Les psychostimulants constituent le traitement de
référence, mais sont dotés d'une toxicité importante. Une molécule non psychostimulante,
l'
atomoxétine, a été mise sur le marché
il
y a quelques années. Cependant, elle est moins
efficace que les psychostimulants,
n'est
disponible que dans certains pays comme les Etats-
Unis et le Canada, mais pas en France, et
n'a
pas encore été autorisée pour l'adulte. Le
manque de spécificité des autres traitements, ainsi que les nombreux effets indésirables qui
leur sont dus, font qu'il existe un réel besoin de développer de nouveaux médicaments dans
cette pathologie.
L'objectif de la première partie de ce travail est de décrire la pathologie et son diagnostic,
ainsi que de faire un état des lieux de sa prise en charge, en faisant une revue des traitements
existants ainsi que de ceux actuellement en développement.
Une seconde partie proposera le développement
d'un
agoniste partiel des récepteurs 5-HT1A,
l'osémozotan (MKC-242), dans cette pathologie, compte tenu du besoin médical non-satisfait
et du potentiel de marché important qu'elle représente, notamment avec le traitement du
TDAH chez l'adulte.
Mots clés : Trouble Déficitaire de
l'
Attention avec Hyperactivité (TDAH), sérotonine,
agoniste 5-HT1A, osérnozotan
2

GRENOB~E
1
UFR
UNIVERSITE
111111!1
DE PHARMACIE
JOSEPH
FOURIER
-
DE
GRENOBLE
SCIENCES.TECHNOLOGIE.SANTÉ.
BAKR!
BOUMENDJEL
BURMEISTER
CALOP
DANEL
DECO
UT
DROUET
DROUET
FAURE
GODIN-RIBUOT
GRILLOT
LENORMAND
PEYRIN
SEVE
RIBUOT
ROUSSEL
WOUESSIDJEWE
Mise
à
jour
le
03/09/2009
UNIVERSITE
JOSEPH
FOURIER
FACULTE DE PHARMACIE
DE
GRENOBLE
Domaine
de
la
Merci
38700
LA
TRONCHE
Doyen
de
la
Faculté :
Mme
Je
Professeur Renée GRILLOT
Vice
-Doyen et Directeur
des
Etudes
:
Mme
Edwige NICOLLE
Année
2009-2010
PROFESSEURS A
L'UFR
DE PHARMACffi (N=l 7)
F
Aziz Pharmacie
Galénique
et Industrielle, Formulation et Procédés
Pharmaceutiques (LR)
Ahcène
Chimie
Organique (D.P.M.)
Wilhebn
Physique
(U.V.H.C.l)
Jean Phannacie Clinique (PU-PH)
Vincent Toxicologie
(SMUR
SAMU
I PU-PH)
Jean-Luc
Chimie
Inorganique (D.P.M.)
Christian Immunologie
Médicale
(GREPI
-
TIMC)
Emmanuel
Microbiologie (U.V.H.C.I)
Patrice Biochimie
(HP2
/
PU-PH)
Diane
Physiologie -Phannacologie (HP2)
Renée
Parasitologie -
Mycologie
Médicale (Directeur UFR I
LAPM,
PU-
PH)
Jean
Luc
Ingénierie Cellulaire, Biothérapies
(Therex,
TIMC)
Eric
Chimie
Analytique
(D.P
.M.)
Michel
Biochimie -Biotechnologie
(IAB,
PU-PH)
Christophe Physiologie -Pharmacologie
(HP2)
Anne-Marie Biochimie Nutrition (L.B.F.A)
Denis
Pharmacotechnie (D.P.M.)
3
DOMAINE DE LA MERCI • 38706 LA TRONCHE
CEDEX·
FRANCE·
TELEPHONE +33 (0)4 76 63
71
OO·
FAX +33 (0)4 76
63
71
70
·----------
..
-~--·---·~----
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
1
/
132
100%