1. DENOMINATION DU MÉDICAMENT Menopur Ferring 75

Résumé des caractéristiques du produit
1. DENOMINATION DU MÉDICAMENT
Menopur Ferring 75 IU, poudre et solvant pour solution injectable
Menopur Ferring 150 IU, poudre et solvant pour solution injectable
Menopur Ferring 600 IU, poudre et solvant pour solution injectable
Menopur Ferring 1200 IU, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Menopur Ferring 75 IU : chaque flacon de poudre contient de la ménotrophine hautement
purifiée (gonadotrophine ménopausique humaine, hMG) ce qui équivaut à 75 unités
internationales d'hormone folliculostimulante (FSH) et 75 unités internationales d'hormone
lutéinisante (LH).
Menopur Ferring 150 IU : chaque flacon de poudre contient de la ménotrophine hautement
purifiée (gonadotrophine ménopausique humaine, hMG) ce qui équivaut à 150 unités
internationales d'hormone folliculostimulante (FSH) et 150 unités internationales d'hormone
lutéinisante (LH).
Menopur Ferring 600 IU : chaque flacon de poudre contient de la ménotrophine hautement
purifiée (gonadotrophine ménopausique humaine, hMG) ce qui équivaut à 600 unités
internationales d'hormone folliculostimulante (FSH) et 600 unités internationales d'hormone
lutéinisante (LH).
Menopur Ferring 1200 IU : chaque flacon de poudre contient de la ménotrophine hautement
purifiée (gonadotrophine ménopausique humaine, hMG) ce qui équivaut à 1200 unités
internationales d'hormone folliculostimulante (FSH) et 1200 unités internationales d'hormone
lutéinisante (LH).
La gonadotrophine chorionique humaine (hCG), une hormone naturellement présente dans
l’urine des femmes post-ménopausées, est présente dans Menopur Ferring et est le principal
fournisseur de l’activité LH.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable.
Aspect visuel de la poudre: masse solidifiée lyophilisée blanche à blanc cassé.
Aspect visuel du solvant: solution incolore limpide.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Menopur Ferring est indiqué pour le traitement de l'infertilité chez la femme dans les cas
cliniques suivants:
- Anovulation y compris le syndrome des ovaires polykystiques (SOPK), chez les femmes qui
n’ont pas réagi à un traitement par citrate de clomifène.
1/12

Résumé des caractéristiques du produit
- Hyperstimulation ovarienne contrôlée pour induire la croissance de plusieurs follicules dans
les techniques de reproduction assistée (TRA) [telles que la fertilisation in vitro/transfert
d'embryon (FIV/TE), transfert intratubaire de gamètes (GIFT) et l'injection
intracytoplasmique de spermatozoïdes (ICSI)].
- Stimulation de la croissance folliculaire chez les femmes ayant un hypogonadisme
hypogonadotrope.
4.2 Posologie et mode d'administration
Le traitement par Menopur Ferring doit être instauré sous le contrôle d'un médecin expérimenté
dans le traitement des problèmes de fertilité.
Mode d'administration
Menopur Ferring est destiné à l'injection sous-cutanée (SC) ou intramusculaire (IM) après
reconstitution avec le solvant fourni.
Menopur Ferring 75 IU et 150 IU
La poudre doit être reconstituée immédiatement avant utilisation. Pour éviter l'injection de gros
volumes, 3 flacons de poudre peuvent être dissous dans 1 ml de solvant fourni.
Menopur Ferring 600 IU et 1200 IU
La poudre doit être reconstituée avant utilisation. La solution préparée est destinée à plusieurs
injections et peut s’utiliser pendant maximum 28 jours.
En général
Il faut éviter de secouer fortement. La solution ne peut être utilisée si un trouble persiste ou si
elle n’est pas limpide.
Posologie
Les schémas de posologie décrits ci-dessous sont identiques pour l’administration SC et IM.
Il existe d'importantes variations inter-individuelles de la réponse des ovaires aux
gonadotrophines exogènes. Il est dès lors impossible de déterminer un schéma posologique
uniforme. La posologie doit donc être adaptée de manière individuelle, en fonction de la réponse
des ovaires. Menopur Ferring peut être utilisé seul ou combiné à un agoniste ou un antagoniste de
la gonadolibérine (GnRH).
Les recommandations concernant la posologie et la durée du traitement peuvent varier en fonction
du protocole utilisé.
Femmes anovulatoires (y compris le SOPK)
Le but du traitement par Menopur Ferring est de développer un seul follicule de Graaf, d’où
l’oocyte sera libéré après administration de choriogonadotrophine humaine (hCG).
Le traitement par Menopur Ferring doit être instauré dans les 7 premiers jours du cycle menstruel.
La dose initiale recommandée est de 75-150 IU par jour, pendant au moins 7 jours. La dose
ultérieure sera déterminée en fonction de la réponse de la patiente, sur base du contrôle clinique
(y compris une échographie ovarienne seule ou en association avec un dosage des taux
d’œstradiol). La dose peut être modifiée au maximum tous les 7 jours. L’augmentation
recommandée est de 37,5 IU et ne peut pas dépasser 75 IU. La dose maximale quotidienne ne
peut pas dépasser 225 IU. Si la réponse de la patiente n’est pas suffisante après 4 semaines de
2/12

Résumé des caractéristiques du produit
traitement, le cycle sera interrompu et la patiente doit débuter un nouveau traitement avec une
dose initiale plus élevée qu’au cours du cycle interrompu.
Lorsqu’une réponse optimale a été obtenue, on administrera, 1 jour après la dernière dose de
Menopur Ferring, une seule injection de 5.000 à 10.000 IU d’hCG. On recommandera à la
patiente d’avoir des rapports le jour et le lendemain de l’administration d’hCG. L’alternative est
une insémination intra-utérine (IIU).
En cas de réponse excessive à Menopur Ferring, le traitement doit être interrompu; on
n’administrera pas d’hCG (voir rubrique 4.4) et la patiente devra utiliser une méthode
contraceptive barrière ou s’abstenir de rapports jusqu’au début de la menstruation suivante.
Femmes qui subissent une hyperstimulation ovarienne contrôlée pour le développement de
plusieurs follicules dans les techniques de reproduction assistée (TRA)
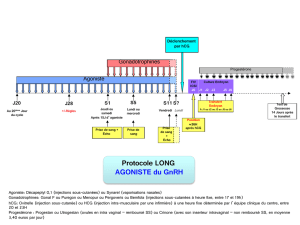
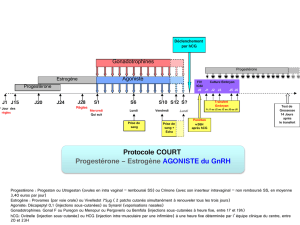
Conformément aux études cliniques réalisées avec Menopur Ferring, dans lesquelles on a
appliqué une régulation à la baisse avec des agonistes de la GnRH, le traitement par Menopur
Ferring doit débuter environ 2 semaines après le début du traitement par l'agoniste. La dose
initiale recommandée de Menopur Ferring est de 150-225 IU par jour pendant au moins les 5
premiers jours de traitement. La dose ultérieure doit être déterminée en fonction de la réponse
individuelle de la patiente, en se basant sur un contrôle clinique (y compris une échographie
ovarienne seule ou combinée à la détermination des taux d'œstradiol), et la modification de la
dose ne peut être supérieure à 150 IU par adaptation. La dose journalière maximale ne peut
dépasser 450 IU et, dans la plupart des cas, il n'est pas recommandé d'administrer le produit plus
de 20 jours.
Dans les protocoles sans régulation à la baisse, le traitement de Menopur Ferring doit débuter le
jour 2 ou 3 du cycle menstruel. Il est conseillé d'utiliser le schéma posologique décrit ci-dessus
pour les protocoles avec régulation à la baisse par agonistes de la GnRH.
Lorsqu'on a obtenu une réponse optimale, il ne faut administrer qu'une seule injection pouvant
aller jusqu'à 10.000 IU d'hCG pour induire la maturation folliculaire finale pour la préparation de
la ponction de l'ovocyte. Les patientes doivent être surveillées de près pendant au moins 2
semaines après l'administration d'hCG. Si on obtient une réponse excessive à Menopur Ferring,
le traitement doit être interrompu et il faut s'abstenir d'administrer de l'hCG (voir rubrique 4.4),
et la patiente doit utiliser une méthode contraceptive de barrière ou s'abstenir de relations
sexuelles jusqu'au début de la menstruation suivante.
4.3 Contre-indications
Menopur Ferring est contre-indiqué chez les femmes qui:
−ont de tumeurs de l'hypophyse ou de l'hypothalamus
−ont de carcinomes des ovaires, de l'utérus ou des seins
−sont enceintes ou qui allaitent
−présentent une hémorragie gynécologique d'étiologie inconnue
−sont hypersensible à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
−kystes ovariens ou ovaires augmentés de volume sans que cela ne résulte d'un syndrome des
ovaires polykystiques.
Dans les cas suivants, un résultat favorable du traitement est peu probable et par conséquent,
Menopur Ferring ne doit pas être administré:
−insuffisance ovarienne primitive
−malformation des organes sexuels incompatible avec une grossesse
−tumeurs fibroïdes de l'utérus incompatibles avec une grossesse.
3/12

Résumé des caractéristiques du produit
4.4 Mises en garde spéciales et précautions d'emploi
Menopur Ferring est une puissante gonadotrophine capable d'induire des effets secondaires légers
à sévères; il ne doit être utilisé que par des médecins familiarisés avec les problèmes d'infertilité
et leur traitement.
Un traitement par gonadotrophine requiert des accords clairs dans le temps avec les médecins et
le personnel d'assistance, et demande un contrôle régulier de la réponse ovarienne par
échographie seule ou combinée à une détermination des taux d'œstradiol. Il existe un certain
degré de variabilité inter-patiente de la réponse à l'utilisation de menotrophine, certaines patientes
répondant moins bien. Il faut administrer la plus faible dose efficace en relation avec l'objectif
thérapeutique.
La première injection de Menopur Ferring doit être administrée sous supervision médicale
directe.
Avant de commencer le traitement, il faut déterminer si l'infertilité du couple convient et il faut
exclure les éventuelles contre-indications pour une grossesse. Les patientes doivent
particulièrement être évaluées en ce qui concerne l'hypothyroïdie, la déficience
corticosurrénalienne, l'hyperprolactinémie et les tumeurs hypophysaires et hypothalamiques, et le
traitement spécifique adéquat doit être administré.
Les patientes qui subissent une stimulation de la croissance folliculaire, tant dans le cadre d’un
traitement pour infertilité anovulatoire que pour TRA, peuvent développer une augmentation de
volume des ovaires ou une hyperstimulation. Le respect du schéma posologique recommandé
pour Menopur Ferring et un contrôle soigneux du traitement réduiront au minimum l'incidence de
ces cas. Une interprétation aiguë des indices du développement et de la maturation folliculaires
exige un médecin expérimenté dans l'interprétation des résultats pertinents.
Syndrome d'hyperstimulation ovarienne (SHO)
Le SHO est un événement médical différent d'une augmentation de volume non compliquée des
ovaires. Le SHO est un syndrome qui peut se manifester avec une sévérité croissante. Il comporte
une augmentation de volume marquée des ovaires, des taux élevés d'hormones sexuelles et une
augmentation de la perméabilité vasculaire, qui peuvent se traduire par une accumulation de
liquide dans les cavités péritonéale, pleurale et rarement péricardique.
On peut observer les symptômes suivants dans les cas graves de SHO: douleur abdominale,
ballonnement abdominal, importante augmentation de volume des ovaires, gain de poids,
dyspnée, oligurie et symptômes gastro-intestinaux, notamment nausées, vomissements et diarrhée.
Une observation clinique peut permettre de détecter une hypovolémie, une hémoconcentration,
des troubles électrolytiques, une ascite, un hémopéritoine, un épanchement pleural, un
hydrothorax, une détresse pulmonaire aiguë et des événements thromboemboliques.
Une réponse excessive des ovaires au traitement par gonadotrophine donne rarement lieu à un
SHO, à moins que de l'hCG ne soit administrée pour déclencher l'ovulation. Il est dès lors
considéré comme prudent, en cas d'hyperstimulation ovarienne, de ne pas administrer d'hCG et de
conseiller à la patiente de s'abstenir de relations sexuelles pendant au moins 4 jours, ou d'utiliser
une méthode contraceptive de barrière. Un SHO peut s'aggraver rapidement (dans les 24 heures à
quelques jours) et devenir un problème médical sévère. Les patientes doivent dès lors être
contrôlées au moins deux semaines après le traitement par hCG.
Le respect du schéma posologique recommandé pour Menopur Ferring et un contrôle soigneux du
traitement réduira au minimum l'incidence de l'hyperstimulation ovarienne et des grossesses
4/12

Résumé des caractéristiques du produit
multiples (voir rubriques 4.2 et 4.8). En cas de TRA, une ponction de tous les follicules avant
l'ovulation peut réduire le risque de survenue d'une hyperstimulation.
Le SHO peut aussi être plus sévère et durer plus longtemps en cas de grossesse. Un SHO se
produit surtout après l'arrêt du traitement hormonal et atteint son maximum environ sept à dix
jours après le traitement. Normalement, un SHO disparaît spontanément avec la survenue de la
menstruation.
S'il se produit un SHO sévère, le traitement par gonadotrophine doit être arrêté s'il est toujours en
cours. La patiente doit être hospitalisée, et il faut instaurer un traitement spécifique pour le SHO.
Ce syndrome présente une incidence plus élevée chez les patientes atteintes d'un syndrome des
ovaires polykystiques.
Grossesse multiple
Une grossesse multiple, surtout de haut rang, s'accompagne d'un risque accru d'effets maternels et
périnataux indésirables.
Chez les patientes qui subissent une induction de l’ovulation au moyen de gonadotrophines,
l’incidence des grossesses multiples est augmentée par rapport à la conception naturelle. La
majorité des grossesses multiples sont des grossesses gémellaires. Pour minimaliser le risque de
grossesse multiple, un contrôle strict de la réponse ovarienne est recommandé.
Chez les patientes qui subissent une procédure de TRA, le risque de grossesse multiple est surtout
lié au nombre et à la qualité des embryons qui sont replacés, et à l'âge de la patiente.
La patiente doit être informée avant le début du traitement du risque potentiel de naissances
multiples.
Interruption de la grossesse
L'incidence d’interruption de la grossesse par une fausse couche et un avortement est plus élevée
que normalement chez les patientes qui subissent une stimulation de la croissance folliculaire
pour induction de l’ovulation dans le contexte de TRA.
Grossesse ectopique
Les femmes avec antécédents d'affection des trompes courent plus de risque de présenter une
grossesse ectopique, aussi bien en cas de conception spontanée que de traitement de la fertilité.
On fait état d'une prévalence de 2 à 5% de grossesses ectopiques après une FIV, contre 1 à 1,5%
dans la population normale.
Néoplasies du système des organes reproducteurs
Il existe des rapports de néoplasies de l'ovaire et d'autres organes reproducteurs, tant bénignes que
malignes, chez les femmes qui ont utilisé plusieurs médicaments pour le traitement de l'infertilité.
On n'a pas encore déterminé si le traitement par gonadotrophines augmente le risque naturel de
ces tumeurs chez les femmes infertiles.
Anomalies congénitales
Après TRA, la prévalence des anomalies congénitales peut être un peu plus importante qu'après
conception spontanée. On suppose que cela est dû à des différences de propriétés parentales
(telles que l'âge de la mère, les propriétés des spermatozoïdes) et aux grossesses multiples.
5/12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%