Téléchargez le PDF - Revue Médicale Suisse

A. Caviezel
S.Terraz
C. D. Becker
C. Iselin
INTRODUCTION
Le cancer du rein représente environ 3% des cancers chez
l’homme et 1,5% chez la femme. La société américaine d’on-
cologie estime le nombre de nouveaux cas à 38 890 en 2006 et
le nombrede décès par cancer du rein à 12840. En Suisse,
l’incidence est actuellement de 15/100000 habitants par an-
née, un chiffre en nette augmentation depuis les années 70
selon le registre suisse des tumeurs.
Auparavant, un grand nombrede nouveaux cas était diagnostiqué lorsque la
maladie était déjà malheureusement à un stade avancé, en raison de la sympto-
matologie souvent tardive de cette pathologie.
En raison du développement récent des techniques d’imagerie non invasives
ces dernières années ainsi que de leurs facilités d’accès, le nombre de tumeurs
rénales asymptomatiques (incidentalomes) diagnostiquées a augmenté de ma-
nière significative. Ces néoplasies sont souvent détectées à un stade précoce
avec une taille plus petite et donc avec un pronostic plus favorable. La population
est aussi souvent plus âgée.
Dans le passé, en raison d’un diagnostic à un stade tardif, la plupart des pa-
tients bénéficiaient d’une chirurgie radicale de type néphrectomie radicale. Ces
dernières années, en raison de la petite taille de ces tumeurs au moment de leur
diagnostic, des techniques d’épargne glomérulaire
(nephron-sparing surgery)
ont
été développées, avec comme but une préservation maximale de la fonction
rénale et une faible morbidité. Des techniques modernes de destruction tissu-
laire localisée par des effets hyperthermiques comme la radiofréquence (RF) ou
des techniques d’hypothermie par cryothérapie (CT) ont été développées et font
désormais partie de l’arsenal thérapeutique urologique. Ces techniques sont
proposées à des patients trop fragiles pour subir une intervention chirurgicale
ou qui désirent éviter une résection chirurgicale classique. Les résultats cliniques
préliminaires sont prometteurs, mais l’efficacité et le contrôle oncologique ainsi
que les résultats en termes de survie nécessitent une évaluation au long cours.
Si les résultats actuels se confirment à terme, il est fort probable que ces techni-
ques puissent devenir dans un futur proche une réelle alternative à la chirurgie
dans la prise en charge des petites tumeurs rénales de taille inférieure à 4 cm.
Cette revue présente les deux techniques les plus utilisées actuellement, leurs
résultats ainsi que leur pratique dans le service en collaboration avec le service
de radiologie.
Minimally invasive ablation techniques for
small kidney tumors :cryoablation and
radiofrequency
Over the last years, the development of mini-
mally invasive surgeryusing percutaneous or
laparoscopic ablative techniques for the treat-
ment of small renal tumours has become more
common. Cryotherapy and radiofrequency op-
tion have been now integrated in the arma-
mentarium of the urologist. These approaches
seem to be an attractive alternative to extir-
pative surgery in selected high-risk patients
and offer on a short time basis equivalent
cancer control to conventional surgery.This
review presents recent data with regard to
the use of cryotherapy and radiofrequency in
the treatment of small renal tumours. These
techniques will obviously have to stand the
test of time.
Rev Med Suisse 2008; 4 : 2642-7
Ces dernières années, le traitement minimalement invasif lapa-
roscopique ou percutané des néoplasies rénales de petite tail-
le s’est développé rapidement. Parmi ces techniques, la cryo-
thérapie et la radiofréquence font désormais partie de l’arsenal
thérapeutique de l’urologue. Ces approches thérapeutiques
sont attractives, car elles offrent une alternative à la chirurgie
àcertains patients à risques, avec un contrôle oncologique sa-
tisfaisant. Cet article présente les deux techniques les plus ré-
pandues, ainsi que les résultats oncologiques dans le traitement
des tumeurs rénales de petite taille.
Traitement minimalement invasif
des petites tumeurs du rein par
cryothérapie et radiofréquence
pratique
2642 Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 0
33685_2642_2647.qxp 27.11.2008 9:16 Page 1

Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 2643
CRYOTHÉRAPIE
Mécanisme de destruction tissulaire
Le principe de destruction tissulaire est basé sur des
cycles rapides de congélation/ réchauffement, provoquant
une nécrose tissulaire. Cet effet est obtenu par le place-
ment de sondes (cryosondes) placées au sein de la tumeur
et dont l’extrémité est ensuite refroidie par un mélange de
gaz circulant, dont le plus répandu se compose d’argon et
d’hélium. Alors que le diamètre des cryosondes était ini-
tialement de 3 à 5 mm, celles qui sont disponibles actuel-
lement ont un diamètre de 17 Gauges (1,47 mm). L’effet
cytotoxique de la cryothérapie est atteint lorsque la tem-
pérature est au moins de - 40°C. Il est essentiel d’obtenir
une telle température à la périphérie de la lésion avec une
marge de sécurité suffisante, afin d'obtenir une ablation
complète.
L’effet cytotoxique est obtenu selon trois mécanismes :
le premier est la formation de cristaux de glace intracel-
lulaires qui aboutit à une destruction par lésion cellulaire
directe pendant le cycle de congélation/décongélation.
Deuxièmement, les lésions de la microcirculation engen-
drent une ischémie, amplifiant le phénomène de nécrose
tissulaire et déclenchant une apoptose (mort cellulaire pro-
grammée) par régulation génétique. Finalement, une voie
complémentaire par stimulation immunologique semblerait
être aussi impliquée.
Application clinique et efficacité oncologique
La cryothérapie peut êtreeffectuée selon deux appro-
ches minimalement invasives principales:la voie laparo-
scopique ou la voie percutanée.
La première approche est réservée à des lésions plutôt
localisées à la face antérieuredu rein, donc plus difficiles
d’accès à une ponction percutanée. Une ou plusieurs cryo-
sondes sont implantées au sein de la lésion tumorale sous
contrôle visuel et/ou échographique et par voie laparosco-
pique transpéritonéale ou rétropéritonéale. Un prélève-
ment de biopsie peropératoirepeut également êtreeffec-
tué dans le même temps. La destruction tumorale peut être
objectivée visuellement par la formation de glace et peut
également êtresuivie par échographie peropératoire. Bien
que l’abordlaparoscopique permette un contrôle peropé-
ratoire précis, des risques de dommage tissulaire des struc-
tures adjacentes (intestin, côlon, pancréas) ont été décrits.
Gill et coll.1ont présenté une série de 56 patients qui
ont subi une cryothérapie pour des lésions rénales de 2,3 cm
de diamètreen moyenne. Le suivi moyen était de trois ans
et la survie sans maladie de 98%. Dans la série de Cestari
et coll.2,70 patients ont été traités par cryothérapie lapa-
roscopique pour des lésions de 2,4 cm, avec un suivi moyen
d’environ 30 mois. Le suivi par IRM a montré une destruc-
tion de la lésion chez tous les patients, sous la forme d’une
cicatrice visible après 24 mois. Un seul patient a subi une
néphrectomie radicale à une année pour une progression
tumorale locale.
La technique percutanée est moins invasive que la voie
laparoscopique. Parfois, elle peut être pratiquée sous sé-
dation légère et anesthésie locale. La ponction peut être
effectuée sous guidage échographique, mais le scanner,et
surtout l’IRM, sont des techniques d’imagerie d’où l’avan-
tage de pouvoir évaluer l’extension de la zone congelée
en cours de procédure.
Sylverman et coll.3ont traité 33 patients, porteurs de 40
tumeurs rénales de 2,6 cm en moyenne, par voie percuta-
née et sous guidage IRM. Lors du suivi moyen de 12 mois
(3 à 43 mois), ils ont identifié une récidive unique à la péri-
phérie de la zone d’ablation préalablement traitée. Dans la
série de Sewel et Shingelton,4103 patients ont été traités
par cryothérapie pour 120 tumeurs d’une taille de 1,1 cm à
7,5 cm, avec un suivi moyen de 35 mois. La survie globale
était de 90% et la survie sans maladie de 97%. A noter que
27% des tumeurs ont nécessité une deuxième séance et que
12% d’entre elles ont nécessité plus de deux traitements
supplémentaires.
Dans notre institution, sept patients ont bénéficié d’une
cryothérapie percutanée rénale sous contrôle IRM.5Les pa-
tients sélectionnés, qui avaient un âge moyen de 61,5 ans,
présentaient un capital néphronique faible : rein solitaire,
insuffisance rénale ou greffe rénale. Après un suivi moyen
de 28 mois (7 à 43 mois), aucune récidive macroscopique n’a
été détectée sur le plan radiologique. Dans les suites de
cette procédure, aucune complication n’a été constatée et le
séjour hospitalier moyen était de 2,4 jours. De plus, la créa-
tinine n’a pas augmenté de façon significative (figure 1).
RADIOFRÉQUENCE
Mécanisme d’action de la radiofréquence
La destruction tissulaireest obtenue par conversion d’on-
des de radiofréquence (RF) à hautes fréquences (500 kHz)
en chaleur, provoquant une nécrose de coagulation. Initia-
lement, le signal de radiofréquence était appliqué à l’élec-
trode située à l’extrémité de l’applicateur de manièrera-
pide et importante, provoquant un effet de dessiccation et
de carbonisation de la néoplasie et du tissu non tumoral.
Ainsi, l’extension de la zone d’ablation était limitée, ne per-
mettant de traiter que de petites lésions de façon incom-
plète. Le développement de nouveaux générateurs, four-
nissant de hautes énergies et autorégulés sur la base de
l’impédance tissulaire, ainsi que l’utilisation d’un système
de refroidissement interne de l’électrode par circulation
d’eau, ont amélioré les performances de cette technique.
En effet, en maintenant une température locale constante
àenviron 100°C, la déposition d’énergie, et par consé-
quent la destruction tissulaire, sont plus étendues et plus
homogènes. Comme pour la cryothérapie, l’opérateur peut
effectuer une ou plusieurs applications de l’électrode de
radiofréquence, dans le but d’obtenir une ablation com-
plète de la lésion.
Application clinique et efficacité oncologique
Al’instar de la cryothérapie, l’ablation tumorale par ra-
diofréquence peut être effectuée en chirurgie ouverte, par
voie laparoscopique ou par voie percutanée.
Matsumoto et coll.6ont présenté une série de 109 pe-
tites tumeurs chez 91 patients traités par radiofréquence,
par voie percutanée et guidée par scanner (n = 63) ou par
laparoscopie (n=46). Le diamètre moyen des tumeurs était
de 2,4 cm. Sur un collectif de 60 patients qui ont été suivis
pendant au moins une année (12 à 33 mois), une seule
0Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008
33685_2642_2647.qxp 27.11.2008 9:16 Page 2

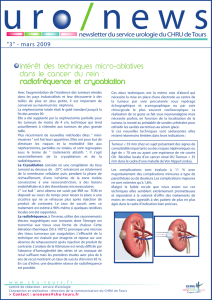
A. L’IRM de repérage montre la présence d’un nodule exophytaire au pôle inférieur du rein gauche. B. La lésion est ponctionnée sous guidage IRM,le patient
étant en procubitus. C. Le contrôle immédiat montre l’extension de la cryolésion, sous la forme d’un hyposignal qui recouvre toute la tumeur.
Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 0
récidive locale a été détectée. Celle-ci a été retraitée avec
succès lors d’une seconde séance de radiofréquence.
Gervais et coll.7,8 ont décrit l’ablation de 100 tumeurs
chez 85 patients. Ils ont montré que les lésions plus pe-
tites ou égales à 3 cm et localisées en périphérie peuvent
êtrecomplètement détruites. Les lésions de 3 à 5 cm et plus
grandes que 5 cm présentaient une nécrose de 92% , res-
pectivement 25%. Les résultats de l’analyse multivariée
laissent donc suggérer qu’une petite taille et une localisa-
tion périphérique du nodule tumoral sont des facteurs in-
dépendants prédictifs de succès après une séance unique
d’ablation par radiofréquence de celui-ci.
Cette technique présente des risques potentiels et
comparables à ceux de la cryothérapie, tels que lésion d’or-
gane avoisinant, hématome péri-rénal ou hématurie, ainsi
que des lésions du système collecteur, pouvant aboutir à
la formation d’un urinome ou de sténoses pyélocalicielles.
Les complications majeures restent relativement rares, si
la sélection multidisciplinaire des patients et la prépara-
tion de l’intervention sont rigoureuses (figure2).
DISCUSSION
Le gold standardactuellement reconnu pour la prise en
charge des tumeurs rénales de petite taille reste l’extirpa-
tion chirurgicale, par voie ouverte ou laparoscopique, car
elle emporte complètement la tumeur avec une marge de
tissu sain. Les techniques d’ablation tissulaire décrites
précédemment (cryothérapie, radiofréquence) sont des mé-
thodes alternatives intéressantes. Il s’agit de techniques
2644 Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008
Figure1.Ablation par cryothérapie sous IRM
A
B
C
Figure2. Ablation par radiofréquence sous CT
-scan
ABC
A. Patient présentant une tumeur maligne de la convexité externe du rein droit. B.Mise en place de deux électrodes de radiofréquence,placées parallèle-
ment au sein de la tumeur sous guidage scanographique.C.Le contrôle en fin de procéduremontreune disparition de l’hypervascularisation de la lésion,
sans complication associée.
33685_2642_2647.qxp 27.11.2008 9:16 Page 3

Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 0
peu invasives, mais qui demandent toutefois une experti-
se technique. La courbe d’apprentissage est plus rapide
que la néphrectomie partielle laparoscopique qui reste un
défi technique pour les chirurgiens. Il est évident que les
considérations oncologiques sont prioritaires. Dès lors, les
technologies minimalement invasives précédemment dé-
crites nécessitent une validation oncologique sur le long
terme avant d’être considérées comme des traitements
standards. Les résultats actuels de la littérature sont enco-
relimités, mais rappellent que la cryothérapie et la radio-
fréquence existent et font actuellement partie de l’arsenal
thérapeutique de l’urologue. Elles doivent être évoquées
comme solution potentielle, notamment chez des patients
âgés porteurs de comorbidités contre-indiquant la chirur-
gie ouverte. Selon la nécessité, en particulier en cas de trai-
tement initial incomplet ou récidive, des traitements ité-
ratifs peuvent être proposés.
Dans une méta-analyse, Uzzo et Novick9ont rapporté
que le contrôle oncologique pour les néphrectomies lapa-
roscopiques partielles est similaire à la néphrectomie ra-
dicale pour les petites tumeurs, avec des taux de compli-
cation variant de 4 à 30% et une moyenne d’environ 14%. La
néphrectomie laparoscopique partielle reste donc grevée
d’un taux de complications significatif. De plus, bien que
considérée comme minimalement invasive, elle reste fina-
lement moyennement invasive comparée aux techniques
percutanées.
Récemment, Hegarty10 de la Cleveland Clinic a présen-
té ses résultats comparant la cryothérapie à la radiofré-
quence :la persistance de maladie tumorale ou récidive a
été identifiée dans 2% des cas traités par cryothérapie et
11% des cas traités par radiofréquence.
D’autres revues de la littérature suggèrent une légère
supériorité de la cryothérapie par rapport à la radiofré-
quence. Cette tendance reste néanmoins à confirmer par
des résultats à long terme.
Dans notre service, nous avons effectué de 2002 à 2007
des traitements par cryothérapie. Depuis 2008, une appro-
che par radiofréquence a été également instaurée (n = 3).
En effet, le repérage des lésions et le contrôle peropéra-
toireest plus simple, sous guidage échographique ou sca-
nographique, alors que l’IRM était nécessairepour la cryo-
thérapie. Actuellement, la procédure se fait sous repérage
et contrôle échographique ou scanographique. Le temps
opératoires’en trouve d’autant plus raccourci. Il est impor-
tant de rappeler que ces techniques sont appliquées dans
des conditions bien précises à des patients préalablement
sélectionnés (tableau 1).
CONCLUSION
Bien que les études cliniques étudiant la survie à long
terme manquent, les techniques d’ablation tissulaire tel-
les que la cryothérapie et la radiofréquence représentent
des solutions alternatives ou complémentaires dans la prise
en charge des petites tumeurs rénales.11 Les résultats onco-
logiques disponibles actuellement chez les patients ayant
bénéficié d’un traitement par cryothérapie sont encoura-
geants et l’efficacité documentée. La cryothérapie est par
ailleurs techniquement plus aisée que la néphrectomie la-
paroscopique partielle avec une morbidité moindre. Bien
que les séries rapportées pour la radiofréquence soient
moins nombreuses, les résultats montrent une efficacité
équivalente pour le traitement des néoplasies rénales de
petite taille. Un recul minimum de cinq à dix ans est sou-
haitable avant de tirer des conclusions définitives.
2646 Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008
1Gill IS, Remer EM, Hasan WA, et al. Renal cryoabla-
tion:Outcome at 3 years. J Urol 2005;173:1903-7.
2Cestari A, Guazzoni G, Dell’Acqua V, et al. Lapa-
roscopic cryoablation of solid venal masses : Interme-
diate term follow-up. J Urol 2004;172:1267-70.
3Silverman SG, T
uncali K, Van Sonnenberg E, et al.
Renal tumors:MR imaging-guided percutaneous cryo-
therapy – initial experience in 23 patients. Radiology
2005;236:716-24.
4Sewel P
, Shingelton W. Five-year treatment success
and survival of patient treated with percutaneous MRI
guided and monitored renal cell carcinoma cryoablation.
Bibliographie
Indications Contre-indications
• Tumeur de petite taille • Tumeur L4cm
l4cm • Jeune âge
• Patients avec risque • Lésion kystique
anesthésique élevé • Tumeur centro-rénale ou
• Lésion solide hilaire
• Tumeur périphérique • Coagulopathie
• Lésions multiples
(von Hippel-Lindau)
• Lésions bilatérales
Tableau 1. Indications et contre-indications au trai-
tement par cryothérapie et radiofréquence
Implications pratiques
La cryothérapie et la radiofréquence font partie de l’arsenal
thérapeutique de l’urologue pour le traitement de certaines
tumeurs rénales de petite taille
Ces modalités thérapeutiques peuvent êtreutiles chez des
patients présentant des comorbidités importantes qui ne per-
mettent pas une prise en charge chirurgicale lourde,une fonc-
tion rénale détériorée ou des risques de tumeurs multifocales
comme dans la maladie de von Hippel-Lindau
>
>
Dr Alessandro Caviezel
Pr Christophe Iselin
Service d’urologie
Département de chirurgie
Dr Sylvain Terraz et Pr Christoph D. Becker
Service de radiologie
Département d’imagerie et des sciences
de l’information médicale
HUG, 1211 Genève 14
Alessandro.Caviez[email protected]
Adresse
33685_2642_2647.qxp 27.11.2008 9:16 Page 4

Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008 26472647 Revue Médicale Suisse
–
www.revmed.ch
–
3décembre2008
BJU Int 2004;94:106.
5Caviezel A,Terraz S,Schmidlin F, Becker C, Iselin CE.
Percutaneous cryoablation of small kidney tumor under
magnetic resonnance imaging guidance: Medium term
follow-up. Scand J Urol Nephrol 2008;1-5 (Epub ahead
of print).
6Matsumoto ED, Johnson DB, Ogan K, et al. Short-
term efficacy of temperature-based radiofrequency abla-
tion of small renal tumors. Urology 2005;65:877-81.
7Gervais DA, McGovern FJ, Arellano RS, McDougal
WS, Mueller PR. Radiofrequency ablation of renal cell
carcinoma:Part 1. Indications,results and role in patient
management over a 6-year period and ablation of 100
tumors.Am J Roentgenol 2005;185:64-71.
8Gervais DA, McGovern FJ, Arellano RS, McDougal
WS, Mueller PR. Radiofrequency ablation of renal cell
carcinoma: Part 2. Lesson learned with ablation of 100
tumors.Am J Roentgenol 2005;185:72-80.
9*Uzzo RG, Novick AC. Nephron sparing surgery
for renal tumors :Indications,techniques and outcomes.
JUrol 2001;166:6-18.
10*Hegarty NJ, Gill IS, Desai MM, et al. Probe-ablative
nephron sparing surgery: Cryoablation versus radio-
frequency ablation. Urology 2006;68:7-13.
11 ** Aron M, Gill IS. Minimally invasive nephron-spa-
ring surgery (MINSS) for renal tumours. Part II : Probe
ablative Therapy. Eur Urol 2007;51:348-57.
*àlire
** à lire absolument
33685_2642_2647.qxp 27.11.2008 9:16 Page 5
1
/
5
100%