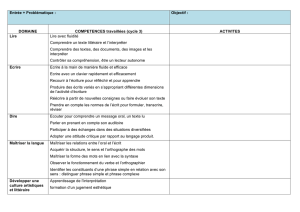
Programme des colles de Physique Chimie BCPST 2ème année

Programme des colles de Physique Chimie
BCPST 2ème année
Semaines du 3 au 13 janvier 2017
Bonne et heureuse année 2017 à tous !
Physique : Thermodynamique
Description des systèmes fermés de composition variable : enthalpie libre G et
potentiel chimique µ
Identité thermodynamique sur la fonction G.
- Relier les grandeurs V, S et µ aux dérivées partielles de G(T, P, n).
Relation de Gibbs – Helmholtz.
- Savoir démontrer la relation de Gibbs – Helmholtz.
Potentiel thermodynamique.
- Relier la variation de l’enthalpie libre et la création d’entropie lors d’une transformation
spontanée à T et P constantes.
- Etablir un critère d’évolution et un critère d’équilibre à partir de l’évolution de G.
Identité d’Euler.
- Relation entre l’enthalpie libre d’un mélange et les potentiels chimiques des constituants.
- Interpréter l’influence d’une variation de P ou de T sur le potentiel chimique.
Activité d’un constituant.
- Définir l’activité d’un constituant dans un mélange idéal.
- Exprimer et utiliser le potentiel chimique d’un constituant dans un mélange idéal (phase
condensée, gaz) et dans une solution diluée.
Changements d’état d’un corps pur
Condition d’équilibre d’un corps pur sous deux phases.
- Interpréter la condition d’équilibre par une égalité de potentiels chimiques.
Enthalpie de changement d’état ; entropie de changement d’état.
- Relier, pour un équilibre entre deux phases, les grandeurs H, S et V aux grandeurs massiques
ou molaires associées et au titre en vapeur.
- Utiliser la relation entre les entropies molaires (massiques) et les enthalpies molaires
(massiques) de changement d’état.
Calorimétrie : Réaliser un bilan enthalpique dans le cas d’un changement d’état.
Révisions associées de BCPST1 :
Notions
Capacités exigibles
Changements d’état du corps pur
Diagramme de phases en coordonnées (T, P) ;
point critique et point triple. Pression de
vapeur saturante.
Variance.
Changement d’état liquide-vapeur ; diagramme
(P, V) ; isothermes.
Titre en vapeur. Théorème des moments.
Interpréter le diagramme (P, V) selon la
variance.
Interpréter qualitativement le palier de
température associé au changement d’état.
Calculer, à partir d’un diagramme, la
composition d’un mélange liquide-vapeur à
l’équilibre.

Chimie : Synthèses Organiques
Indications du programme actuel de BCPST2 :
La création de liaisons entre deux atomes de carbone mobilise l’ensemble des connaissances
en chimie organique. La vision globale qui en résulte permet de comprendre les étapes
apparaissant dans les grands cycles de la biochimie ou dans une synthèse totale. Elle permet
également l’élaboration d’une stratégie de synthèse visant à allonger le squelette carboné d’un
nombre donné d’atomes.
L’ion cyanure
Substitution nucléophile par l’ion cyanure.
- Ecrire le mécanisme de la réaction de l’ion cyanure sur un composé halogéné.
Addition nucléophile par l’ion cyanure.
- Ecrire le mécanisme de l’addition de l’ion cyanure sur un composé carbonylé suivie d’un
traitement à pH contrôlé.
Les organomagnésiens mixtes
Synthèse d’un organomagnésien.
- Justifier l’utilisation de l’éthoxyéthane ou du tétrahydrofurane comme solvant.
- Justifier les précautions mises en œuvre.
Réactivité.
- Justifier l’inversion de polarité sur l’atome de carbone résultant de l’insertion de magnésium
dans la liaison carbone – halogène.
- Ecrire les schémas réactionnels sur les composés suivants : composés carbonylés, esters,
dioxyde de carbone et oxirane.
Révisions associées de BCPST1 :
Notions
Capacités exigibles
Délocalisation électronique et aromaticité
Mésomérie.
Conjugaison et conséquences structurales.
Aromaticité ; critère de Hückel.
Interactions de faible énergie
Interaction de Van der Waals
Liaison hydrogène ; directivité.
Solvant
Rôle du solvant.
Exemples : solvants apolaires, polaires
aprotiques et polaires protiques.
Ecrire les formules résonantes d’une molécule.
Utiliser la géométrie et la conjugaison pour
interpréter la géométrie et la réactivité.
Comparer les ordres de grandeur des énergies
mises en jeu (liaison covalente, liaison
hydrogène, liaison de Van der Waals).
Faire le lien entre les propriétés du solvant et
les interactions intermoléculaires.
Interpréter qualitativement la méthode de
l’extraction liquide-liquide.
Stéréochimie
Ecriture topologique.
Représentation spatiale des molécules : Cram,
Newman, perspective.
Conformations des alcanes linéaires et du
cyclohexane.
Représenter une molécule à partir de son nom,
en tenant compte d’informations
stéréochimiques, dans un type de représentation
donnée.
Discuter la stabilité relative de deux
conformations d’un alcane.

Glucopyranoses ; anomérie ; existence de la
mutarotation du glucose.
Carbone asymétrique, chiralité, énantiomérie,
diastéréoisomérie.
Descripteurs sétérochimiques Z/E, R/S, D/L.
Activité optique, pouvoir rotatoire, loi de Biot.
Mélange racémique.
Représenter le conformère le plus stable d’un
cyclohexane monosusbstitué.
Déterminer si une molécule est chirale.
Identifier les relations de stéréoisomérie entre
deux composés.
Comparer les propriétés de deux
stéréoisomères de configuration, en milieu
chiral et non chiral.
Déterminer les descripteurs stéréochimiques
dans les cas simples.
Utiliser la loi de Biot pour discuter de la pureté
énantiomérique d’un mélange.
Substitutions nucléophiles
Nucléophile et nucléofuge.
Les deux mécanismes limite : SN1 et SN2 pour
les halogénoalcanes et les alcools.
Activation des alcools par H+ et par le
chlorure de tosyle.
Ouverture d’un époxyde en milieu basique
Elimination
Compétition entre SN et E.
Régiosélectivité de l’élimination.
Mécanismes limites E1 et E2 pour les
halogénoalcanes et les alcools.
Additions nucléophiles
Bilan et mécanisme d’une addition nucléophile
sur le groupe carbonyle suivie d’une hydrolyse.
Bilan et mécanisme de l’hémiacétalisation et de
l’acétalisation.
Expliciter la réactivité des liaisons C-X et C-
OH.
Identifier les sites électrophiles et/ou
nucléophiles d’une espèce chimique.
Reconnaître des nucléophiles usuels : ion
cyanure, ion alcoolate, amine, ion hydroxyde,
eau.
Discuter du mécanisme à partir de données
cinétiques.
Déterminer les stéréoisomères obtenus à l’issue
d’une SN.
Discuter de la compétition entre les deux
mécanismes en fonction de la structure du
carbocation.
Représenter les profils réactionnels associés à
chaque mécanisme.
Ecrire l’équation bilan de l’action du chlorure
de tosyle sur un alcool.
Interpréter la stéréochimie de la
dihydroxylation d’un alcène. Comparer les diols
obtenus à partir d’un alcène via l’époxydation
ou par action du permanganate.
Reconnaître les conditions favorisant
l’élimination : température, force et
concentration de la base.
Déterminer le produit majoritaire de
l’élimination.
Ecrire les stéréoisomères obtenus à l’issue d’une
élimination.
Expliciter la différence de réactivité de la
double liaison C=O et de la double liaison
C=C.
Expliciter le caractère renversable de
l’acétalisation.
Utiliser l’acétalisation comme protection de
groupe caractéristique.
1
/
3
100%