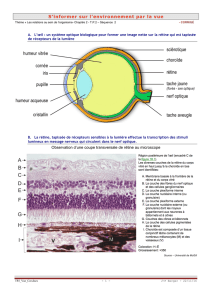
Epilepsies et anomalies du développement cérébral

doi: 10.1684/epi.2009.0211
Epilepsies et anomalies
du développement cérébral :
aspects génétiques
Pierre Szepetowski
Institut de Neurobiologie de la Méditerranée (INMED), Inserm U901,
groupe « génétique des épilepsies isolées et associées » (GEIA), campus scientifique de Luminy,
163, route de Luminy, BP 13, 13273 Marseille cedex 09, France
Résumé. Les altérations des processus du développement cortical sont fréquemment associées à des crises
épileptiques, généralement difficilement contrôlables. L’incidence des malformations corticales n’est pas connue,
mais augmente avec l’amélioration des techniques de détection. La classification actuelle est basée sur des critères
embryologiques, génétiques et de neuro-imagerie, et un certain nombre de gènes responsables de syndromes plus
ou moins classiques ont été mis en évidence. On distingue ainsi schématiquement les malformations par anomalies
de la prolifération cellulaire (dysplasie corticale focale : gène CNTNAP2 ; sclérose tubéreuse : gènes TSC1 et TSC2),
par anomalies de la migration neuronale (hétérotopie nodulaire périventriculaire : gènes FLNA et ARFGEF2 ; lissen-
céphalie, hétérotopie laminaire sous-corticale : gènes PAFAH1B (LIS1), DCX, TUBA1A, ARX, RELN ; lissencéphalie
frontopariétale type cobblestone : gène GPR56) et par anomalies de l’organisation corticale (polymicrogyrie bilaté-
rale périsylvienne : gène SRPX2). La mise en évidence et l’étude de formes mixtes associant ces différents syndro-
mes entre eux, et de continuums cliniques et moléculaires incluant syndromes épileptiques avec et sans anomalie
corticale apparente, représentent les deux enjeux majeurs des prochaines années.
Mots clés :épilepsie,cortex,développement,génétique
Abstract. Epilepsies and abnormal cortical development: genetic aspects
Altered cortical development is frequently associated with often-intractable epileptic seizures. Incidence of cortical
malformation is not known with precision but tends to increase asdetection methods become more and more efficient.
The current classification is based on embryological, genetic and neuro-imaging criteria and several genes that are
responsible for various syndromes of cortical malformation with epileptic seizures, have been identified. Schematically,
it is usual to distinguish between syndromes resulting from altered cellular proliferation (focal cortical dysplasia:
CNTNAP2 gene; tuberous sclerosis: TSC1 and TSC2 genes), from altered neuronal migration (periventricular nodular
heterotopia: FLNA and ARFGEF2 genes; lissencephalia, subcortical laminar heterotopia: PAFAH1B (LIS1), DCX,
TUBA1A, ARX, RELN genes; frontoparietal lissencephalia, cobblestone type: GPR56 gene) and from altered cortical
organization (bilateral perisylvian polymicrogyria: SRPX2 gene). The identification and the study of mixed forms
variably associating those different syndromes, and of the clinical and molecular continuum comprising epileptic
syndromes with and without detectable cortical anomaly, will represent a major challenge in the next years.
Key words:epilepsy,cortex,development,genetics
Épilepsie et anomalies du développement du cortex cérébral (II)
Épilepsie et anomalies du développement du cortex cérébral (II)
Épilepsies 2009 ; 21 (1) : 12-5
Tirés à part :
P. Szepetowski
Épilepsies, vol. 21, n° 1, janvier-février-mars 2009 12
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

La formation du cortex cérébral au cours du développement est
àl’évidence un phénomène complexe qu’il est habituel de sub-
diviser en trois étapes principales : prolifération cellulaire dans
les zones germinales, migration cellulaire par diverses routes
possibles vers le cortex et organisation corticale avec extension
de neurites et établissement de connexions synaptiques. L’alté-
ration de l’une quelconque de ces étapes se traduit par des
atteintes morphologiques caractéristiques permettant, sur la
base de critères embryologiques, génétiques (voir plus bas) et
de neuro-imagerie, d’établir une classification des malforma-
tions du développement cortical.
Les crises épileptiques sont les conséquences d’activités
anormales et paroxystiques se produisant principalement dans
le cortex cérébral. De ce fait, il n’est pas étonnant qu’une alté-
ration des processus du développement cortical soit fréquem-
ment associée à des crises épileptiques, et que ces crises soient
difficilement contrôlables. Dans le cadre des malformations
corticales, les crises surviennent très probablement du fait du
mauvais positionnement de neurones corticaux et/ou de la pré-
sence de neurones corticaux anormaux. Les anomalies géné-
rées au niveau des circuits corticaux conduiraient ainsi à une
altération des influences inhibitrices et excitatrices qui contrô-
lent les décharges électriques et qui, à l’état physiologique,
empêchent la survenue des crises.
L’incidence des malformations corticales n’est pas connue,
mais à l’évidence, la fréquence de leur détection augmente
avec l’amélioration des techniques de neuro-imagerie cérébrale
(imagerie par résonance magnétique [IRM]). De ce fait et en
parallèle, la frontière séparant crises d’épilepsie survenant
dans le cadre d’une malformation corticale avérée, d’une part,
et épilepsies apparemment idiopathiques, d’autre part, cette
frontière, donc, qui semblait intangible, il y a quelques années
encore, devient avec les progrès concomitants de la neuro-
imagerie cérébrale et de la génétique plus floue, au moins
conceptuellement. Dans le même ordre d’idées, la classification
classique des anomalies du développement cortical en trois
grands sous-groupes mécanistiques, qui pour des raisons prati-
ques sera celle utilisée ici (voir plus bas), est certainement
vouée à être en partie contredite au niveau moléculaire, dans
la mesure où des formes mixtes aux mécanismes complexes et
non univoques seront de mieux en mieux caractérisées.
Anomalies de la prolifération cellulaire
Dysplasie corticale focale
Il s’agit d’une cause fréquente d’épilepsie partielle réfrac-
taire aux traitements médicamenteux, dont l’origine n’est pas
encore parfaitement élucidée. Les tentatives de classification
des dysplasies corticales, en fonction du degré de dysplasie et
de la présence de cellules anormales (cellules « en ballon » par
exemple), ne sont pas complètement satisfaisantes. S’il a été
proposé que le terme de dysplasie corticale soit réservé aux
lésions avec anomalies architecturales (dyslamination, cellules
anormales dans le cortex), la détection de microdysgénésies, où
les anomalies corticales sont subtiles (hétérotopies neuronales,
ondulations des couches corticales), pose la question de leur
« normalité ». Outre les crises épileptiques qui peuvent surve-
nir à des périodes variables (depuis la vie in utero jusqu’àl’âge
adulte, mais le plus souvent durant l’enfance), les dysplasies
corticales focales peuvent se caractériser par un retard de déve-
loppement et une insuffisance intellectuelle.
L’étiologie des dysplasies focales corticales est généralement
inconnue. Chez des enfants de la communauté Amish avec dys-
plasie corticale, macrocéphalie, crises d’épilepsie réfractaires et
régression du langage, une mutation homozygote et, très proba-
blement, fondatrice du gène CNTNAP2 a été décrite (Strauss et
al., 2006). La protéine CNTNAP2 est une contactine de la super-
famille des neurexines qui sont impliquées dans les phénomè-
nes d’adhérence cellulaire et peut s’associer à diverses sous-
unités de canaux potassiques. Ce même gène pourrait aussi
sous-tendre une susceptibilité génétique aux troubles autisti-
ques (Arking et al., 2008) et aux troubles spécifiques du langage
(Vernes et al., 2008). La régulation du gène CNTNAP2 par le fac-
teur transcriptionnel FOXP2, dont les mutations peuvent direc-
tement causer des troubles de la production du langage articulé
(dyspraxie orale et de la parole), vient d’être démontrée (Vernes
et al., 2008). Ainsi, des mutations (directement causales) ou des
variations (de susceptibilité) d’un seul gène semblent-elles sous-
tendre des pathologies distinctes avec ou sans anomalie détec-
table du développement.
Sclérose tubéreuse
Un cas à part est représenté par les dysplasies corticales foca-
les survenant dans le cadre de la sclérose tubéreuse. Ce syndrome
autosomique dominant, dont l’incidence avoisine 1/6 000 nais-
sances, n’affecte pas que le cerveau et se caractérise au niveau de
ce dernier par des anomalies de la différenciation et de la prolifé-
ration cellulaires, neuronales et gliales. Les crises épileptiques qui
existent dans environ 80 % des cas sont généralement partielles,
et les spasmes infantiles ne sont pas rares. Génétiquement, qua-
tre loci sont identifiés, et pour deux d’entre eux qui représentent
90 % des cas, les gènes responsables de sclérose tubéreuse sont
connus (Curatolo et al.,2008).Ils’agit de TSC1 (chromosome
9q34) et TSC2 (chromosome 16p13). TSC1 code pour la protéine
hamartine qui, en s’y associant, stabilise la tubérine, produit pro-
téique du gène TSC2. Au niveau moléculaire, le complexe pro-
téique TSC1-TSC2 possède une activité GAP (GTPase-activatrice)
dirigée vers la petite protéine G Rheb et régule ainsi négative-
ment la voie mTOR (mammalian target of rapamycine) qui a un
rôle dans la croissance et la morphologie cellulaires.
Anomalies de la migration neuronale
Hétérotopie nodulaire périventriculaire
Concernant la substance grise, l’hétérotopie, qui n’est pas
rare et siège le plus souvent dans la zone périventriculaire ou
dans la substance blanche, suggère un défaut de migration
neuronale. L’épilepsie survient dans la grande majorité des cas
Aspects génétiques
Épilepsies, vol. 21, n° 1, janvier-février-mars 2009
13
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

et est le plus souvent réfractaire aux traitements médicamen-
teux. Dans la majorité des formes héréditaires, des mutations
du gène FLNA codant pour la filamine A ont été identifiées
(Fox et al., 1998). Le gène étant situé sur le chromosome X, la
plupart des mutations sont létales chez l’homme, et seules les
femmes présentent généralement la pathologie. FLNA peut
également être muté dans des formes sporadiques. La filamine
A est une protéine exprimée de façon ubiquitaire et est cruciale
pour la formation du cytosquelette d’actine. Outre ce gène, des
mutations du gène ARFGEF2 (ADP-ribosylation factor guanine
nucleotide exchange factor 2), dont le produit protéique participe
au transport des vésicules dans la cellule, ont été retrouvées
dans des formes autosomiques récessives avec consanguinité
(Sheen et al., 2004). Il est fort probable que d’autres loci géné-
tiques soient impliqués, par exemple, par altérations du nom-
bre de copies de certaines régions génomiques du chromosome
5 (Sheen et al., 2003 ; Cardoso et al., 2008).
Lissencéphalie et hétérotopie laminaire sous-corticale
La lissencéphalie classique (encore dite de type I ou agyrie-
pachygyrie) est caractérisée par une gyration corticale défi-
ciente, voire absente. Son incidence est d’environ 1 pour
100 000 naissances. Les scissures principales (Rolando, Sylvius)
sont peu développées, et d’autres anomalies peuvent être diver-
sement associées. Les manifestations cliniques associent classi-
quement hypotonie à la naissance, crises épileptiques réfractai-
res et déficit intellectuel modéré à profond. Plusieurs gènes
responsables sont connus (Guerrini et al., 2008).
Un premier gène responsable de lissencéphalie est
PAFAH1B1, qui code pour la protéine LIS1, sous-unité alpha
non catalytique de l’isoforme 1b du facteur d’activation pla-
quettaire, et qui a une fonction acétylhydrolase. Un premier
partenaire protéique de LIS1, PAF-AH, est impliqué dans la
régulation des flux calciques au niveau des récepteurs synapti-
ques glutamatergiques de type NMDA. Par l’intermédiaire d’un
autre de ses partenaires, la protéine NDEL1 (NUDEL), LIS1 peut
interagir avec la chaîne lourde de la dynéine qui est fixée aux
microtubules cytoplasmiques. La perte de fonction de LIS1
pourrait ainsi perturber la translation des noyaux des neurones
au cours de leur migration. De plus, LIS1 pourrait également
intervenir au cours de la neurogenèse. D’autres gènes de lissen-
céphalie sont connus : YWHAE code pour une protéine égale-
ment impliquée dans la régulation du complexe de la dynéine.
DCX (double cortine) est un gène situé sur le chromosome X ;
les garçons porteurs de mutations de DCX ont une lissencépha-
lie classique, alors que chez les filles, les mutations du gène
causent « seulement » une hétérotopie laminaire sous-
corticale (« double-cortex »). DCX est une protéine capable
d’interagir avec LIS1 et avec la tubuline et participe à la stabili-
sation des microtubules. Des mutations de TUBA1A, qui code
pour une sous-unité alpha de la tubuline, ont d’ailleurs été
récemment rapportées. Des mutations des gènes ARX
(aristaless-related homeobox, X-linked)etRELN (reelin) peuvent
également causer des lissencéphalies parfois associées à d’autres
anomalies (hypoplasie cérébelleuse par exemple).
À côté de ces formes classiques, existent les lissencéphalies
dites pavimenteuses (cobblestone), dont la forme la plus com-
mune est le syndrome de Walker-Warburg, et qui peuvent
être associées à des défauts dans l’O-glycosylation du dystro-
glycane, une glycoprotéine dont l’isoforme alpha, située dans
la matrice extracellulaire, fait, avec la bêta-dystroglycane
transmembranaire, le lien entre le réseau fibrillaire extracellu-
laire et la dystrophine. Des mutations des gènes POMT1,
POMT2 et POMGnT1, tous trois impliqués dans le processus
d’O-glycosylation du dystroglycane, ont été identifiées.
Les gènes FCMD (fukutine) et FRKP, également mutés dans
des malformations cobblestone, codent probablement pour des
glycosyltransférases golgiennes. Une forme particulière de mal-
formation corticale cobblestone est celle touchant de manière
bilatérale l’aire frontopariétale. Historiquement appelé « poly-
microgyrie » frontopariétale, ce syndrome est dû à des muta-
tions du gène GPR56 qui code pour un récepteur couplé aux
protéines G (Piao et al., 2004). Les mutations semblent entraî-
ner un défaut d’adressage du récepteur à la membrane
plasmique.
Les mutations du gène DCX chez les filles (voir plus haut)
et, plus rarement, celles du gène LIS1 peuvent causer une hété-
rotopie laminaire sous-corticale. Dans le cas du gène DCX, les
filles ont, du fait de l’inactivation classiquement aléatoire d’un
des deux chromosomes X, la moitié de leurs neurones migrant
normalement (le gène muté est inactif) et l’autre moitié
migrant anormalement. Il arrive que des mutations de DCX
n’entraînent que retard mental ou épilepsie, posant la question
de l’existence d’anomalies de la migration non (encore ?)
détectables.
Anomalies de l’organisation corticale
Polymicrogyrie et schizencéphalie
La polymicrogyrie correspond à l’existence de gyri peu pro-
fonds et en nombre excessif. D’incidence inconnue, elle est le
plus souvent périsylvienne et peut être associée à diverses
autres anomalies (corps calleux, cervelet, etc.). Elle est classi-
quement considérée comme résultant d’une anomalie dans les
dernières étapes de la migration corticale et dans les premières
phases de l’organisation corticale. Outre des facteurs généti-
ques évidents (Jansen et Andermann, 2005), des causes non
génétiques telles qu’infection intra-utérine au cytomégalovirus
(CMV) ou hypoperfusion placentaire sont bien connues.
La polymicrogyrie bilatérale périsylvienne (BPP), qui asso-
cie diversement épilepsie, trouble de la parole et altérations
cognitives, est génétiquement hétérogène. Notamment, des
liaisons génétiques à plusieurs loci sur le chromosome X ont
été rapportées, et un gène, SRPX2, est muté dans une famille
avec BPP chez le garçon atteint et avec altérations cognitives
de degré variable chez les apparentées porteuses de la mutation
(Roll et al., 2006). La mutation est associée à une affinité accrue
de la protéine SRPX2 pour son récepteur uPAR (récepteur de
l’activateur du plasminogène de type urokinase) (Royer-
P. Szepetowski
Épilepsies, vol. 21, n° 1, janvier-février-mars 2009 14
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Zemmour et al., 2008), lequel récepteur est impliqué chez la
souris, dans la migration tangentielle des interneurones gabaer-
giques, au cours du développement cérébral. Il est intéressant
de noter qu’une autre mutation de SRPX2 cause une épilepsie
rolandique avec dyspraxie orale et de la parole (syndrome
RESDX) (Roll et al., 2006), indiquant l’existence probable d’un
continuum moléculaire entre syndromes avec anomalie avérée
(détectable) du développement cérébral et syndromes sans ano-
malie apparente, du moins avec la résolution des méthodes
d’imagerie utilisées actuellement. Dans le même ordre d’idée,
des membres de famille, dans lesquels certains patients ont
une BPP prouvée, peuvent avoir des signes cliniques sans ano-
malie cérébrale à l’IRM.
Des altérations génomiques ont, par ailleurs, été mises en
évidence dans les polymicrogyries. Dans la schizencéphalie,
anomalie classiquement reliée à la polymicrogyrie, outre les cau-
ses non génétiques citées plus haut (CMV par exemple), des
mutations du facteur de transcription EMX2 ont été proposées.
Conclusion
Comme cela a été souligné plus haut, la classification utili-
sée ne rend compte que très imparfaitement de la complexité
des mécanismes conduisant aux pathologies présentées ici, et
évidemment de ceux associés au développement du cortex
cérébral. On l’a vu, la « polymicrogyrie » frontopariétale n’en
est pas vraiment une ; les polymicrogyries, au sens large, peu-
vent sans doute procéder d’anomalies de la migration neuro-
nale ou d’altérations de l’organisation du cortex ou encore,
plus certainement, de l’association des deux ; des formes syn-
dromiques mixtes peuvent aussi coexister, comme en atteste
par exemple l’association décrite entre hétérotopie nodulaire
périventriculaire et polymicrogyrie (Wieck et al., 2005).
Les anomalies du développement du cortex cérébral sont
une cause fréquente de crises épileptiques, survenant souvent
durant l’enfance et fréquemment résistantes aux anti-
épileptiques, et associées à d’autres désordres touchant la cogni-
tion, le langage, etc. L’existence de plus en plus plausible d’un
continuum de pathologies reliées entre elles souligne l’implica-
tion probable de bases moléculaires communes aux pathologies
à la fois sévères, « développementales » et aux pathologies plus
bénignes, sans anomalie décelable. Comme cela a été proposé
plus généralement pour la pathologie cérébrale dans son
ensemble (Ben Ari, 2008), la question de l’origine développe-
mentale possible de syndromes épileptiques plus communs et
de diagnostic plus tardif doit être évoquée.
□
Références
Arking DE, Cutler DJ, Brune CW, et al. A common genetic variant in
the neurexin superfamily member CNTNAP2 increases familial risk of
autism. Am J Hum Genet 2008 ; 82 : 160-4.
Ben-Ari Y. Neuro-archaeology: pre-symptomatic architecture and
signature of neurological disorders. Trends Neurosci 2008 ; 31 : 626-36.
Cardoso C, Boys A, Parrini E, et al. Periventricular heterotopia, mental
retardation and epilepsy associated with 5q14.3-q15 deletion. Neurology
2008 (in press). [Epub ahead of print].
Curatolo P, Bombardieri R, Jozwiak S. Tuberous sclerosis. Lancet
2008 ; 372 : 657-68.
Guerrini R, Dobyns WB, Barkovich AJ. Abnormal development of the
human cerebral cortex: genetics, functional consequences and treatment
options. Trends Neurosci 2008 ; 31 : 154-62.
Jansen A, Andermann E. Genetics of the polymicrogyria syndromes.
J Med Genet 2005 ; 42 : 369-78.
Piao X, Hill RS, Bodell A, et al. G protein-coupled receptor-dependent
development of human frontal cortex. Science 2004 ; 303 : 2033-6.
Roll P, Rudolf G, Pereira S, et al. SRPX2 mutations in disorders of lan-
guage cortex and cognition. Hum Mol Genet 2006 ; 15 : 1195-207.
Royer-Zemmour B, Ponsole-Lenfant M, Gara H, et al. Epileptic and
developmental disorders of the speech cortex: ligand-receptor interaction
of wild-type and mutant SRPX2 with the plasminogen activator receptor
uPAR. Hum Mol Genet 2008 ; 17 : 3617-30.
Sheen VL, Wheless JW, Bodell A, et al. Periventricular heterotopia
associated with chromosome 5p anomalies. Neurology 2003 ; 60 : 1033-6.
Sheen VL, Ganesh VS, Topcu M, et al. Mutations in ARFGEF2 impli-
cate vesicle trafficking in neural progenitor proliferation and migration
in the human cerebral cortex. Nat Genet 2004 ; 36 : 69-76.
Strauss KA, Puffenberger EG, Huentelman MJ, et al. Recessive sympto-
matic focal epilepsy and mutant contactin-associated protein-like 2. N
Engl J Med 2006 ; 354 : 1370-7.
Vernes SC, Newbury DF, Abrahams BS, et al. A functional genetic link
between distinct developmental language disorders. N Engl J Med 2008 ;
359 : 2337-45.
Wieck G, Leventer RJ, Squier WM, et al. Periventricular nodular hete-
rotopia with overlying polymicrogyria. Brain 2005 ; 128 : 2811-21.
Aspects génétiques
Épilepsies, vol. 21, n° 1, janvier-février-mars 2009
15
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
4
100%