tp5 organisation et mise en place du systeme nerveux central

TP5 ORGANISATION ET MISE EN PLACE DU SYSTEME NERVEUX CENTRAL.
activité 1: techniques d'imagerie cérébrale et résultats
Légendez les schémas ci-dessous (vous pouvez trouver une partie des légendes p218).
activité 2: étude de l'aire somatosensorielle
Le terme somatosensoriel désigne les différentes formes de sensibilité provenant de l'ensemble du corps (sensibilité
tactile, à la chaleur, à la douleur, musculaire et articulaire).
1. On cherche à déterminer la sensibilité tactile de différentes zones du corps (doigt, bras..). Vous disposez d’un système
composé de deux pointes que l’on peut écarter l’une de l’autre.
Un élève applique de façon aléatoire sur un autre élève cobaye soit une pointe, soit les deux (en veillant à exercer la même
pression sur chaque pointe). Il réalise 10 stimulations. Pour chacune, le cobaye indique s’il perçoit une ou deux pointes.
N.B: il est évident que le cobaye ne doit pas regarder les pointes lorsqu’elles lui sont appliquées!
Réalisez cette manipulation sur un doigt puis sur le bras avec un écartement assez important et notez les
résultats.
Recommencez cette manipulation avec un écartement plus faible.
Comparez les résultats obtenus.
2. Lisez le document 1 p222 et répondez à la question 1 p223.
3. Lisez les documents 2 et 3 p223 et répondez à la question 2.
activité 3: contrôle génétique de la mise en place du système nerveux central
Lisez le texte « une anomalie génétique du cortex » (document joint) et répondez aux questions suivantes.
1. Dégagez les phénotypes macroscopiques des deux anomalies (lissencéphalie et hétérotopie).
2. Indiquez les anomalies du cortex, visibles sur les documents joints, à l’origine de ces phénotypes.
(vous pouvez répondre aux questions 1 et 2 sous la forme d'un tableau)
3. Indiquez les arguments qui ont permis de conclure à une origine génétique de ces anomalies d’une part, et de
préciser la localisation du gène en cause d’autre part.
4. Indiquez l’intérêt d’étudier le gène en cause.
activité 4: plasticité du système nerveux central
1. Lisez les documents 1 et 2 p228 et exploitez ces expériences.
2. Proposez une ou plusieurs explications.
coupe avant – arrière de l’encéphale
coupe transversale des hémisphères cérébraux

TP5 ORGANISATION ET MISE EN PLACE DU SYSTEME NERVEUX CENTRAL - REPONSES.
activité 1: techniques d'imagerie cérébrale et résultats
vidéo
hémisphère cérébral droit
ventricule
thalamus = noyaux gris
cervelet
bulbe rachidien
moelle épinière
substance grise
substance blanche
ventricule
thalamus= noyaux gris
activité 2: étude de l'aire somatosensorielle
1. doigt
écartement important
écartement faible
stimulation
sensation
adéquation
bras
écartement important
écartement faible
stimulation
sensation
adéquation
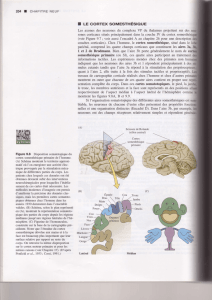
On constate que la sensibilité est meilleure au niveau du doigt (les récepteurs sensoriels sont plus nombreux).
2. L'étendue de la représentation corticale d'une région du corps n'est pas liée à sa superficie réelle mais à la densité des terminaisons sensorielles qui existent
dans cette partie du corps.
3. Chez les trois animaux, les régions correspondant à la tête et aux membres antérieurs sont très étendues et en particulier la région correspondant aux vibrisses
chez la Souris. Chez le Singe, la région correspondant aux pieds est également très développée. Ces spécificités sont à relier avec le mode de vie des animaux.
activité 3: contrôle génétique de la mise en place du système nerveux central
1 et 2.
lissencéphalie
hétérotopie
phénotype
macroscopique
- touche uniquement des garçons
- retard mental profond et crises d’épilepsie réfractaires à tout
traitement
- concerne les filles
- symptômes très variables: certaines ont un retard mental léger et
quelques crises d'épilepsie dans l'enfance alors que d'autres ont des
symptômes aussi graves que les garçons
anomalies
du cortex
absence de replis du cortex cérébral (donc surface moins importante)
présence de bandes de substance grise (autres que les noyaux gris)
au sein de la substance blanche
3. Le fait que certaines familles sont plus touchées que d'autres a permis la mise en évidence de mutations associées à ces pathologies, elles ont donc une origine
génétique.
La transmission par la mère et la gravité des formes affectant les garçons suggèrent une localisation du gène sur le chromosome X
4. Deux intérêts peuvent être dégagés:
- la fabrication de modèles animaux où le gène
Doublecortine
sera inactivé permettra de mieux comprendre les mécanismes de l’organisation du cortex
- la connaissance des mutations potentielles que contient ce gène permettra un diagnostic moléculaire de la maladie chez les filles d'une famille atteinte et
pendant la grossesse.
activité 4: plasticité du système nerveux central
1. Dans la première expérience, on observe la représentation somatosensorielle de la main droite d'un Singe avant et après amputation du majeur de cette main.
On constate que la partie associée au majeur a disparu après l'amputation et que les parties associées aux doigts 2, 4 et 5 se sont développées.
Dans la deuxième expérience, on observe encore la représentation somatosensorielle de la main droite d'un Singe mais cette fois avant et après entraînement à
une tâche qui nécessite l'utilisation préférentielle des doigts 2, 3 et 4. On constate que les parties associées à ces doigts se sont développées ainsi que la partie
associée au pouce. La partie associée au doigt 5 a régressé.
On peut donc affirmer que l'organisation du cortex somatosensoriel n'est pas figée, elle peut être modifiée par l'expérience individuelle. On parle de plasticité
cérébrale.
2. Explications possibles:
- les neurones peuvent mourir ou se multiplier en fonction de la sollicitation des zones correspondantes
- les synapses sont modifiées et les réseaux de neurones sont réorganisés

UNE ANOMALIE GENETIQUE DU CORTEX
Les circonvolutions cérébrales augmentent la surface du cortex, la surface des aires cérébrales fonctionnelles et
le nombre des connexions entre neurones, améliorant les performances cognitives*. Chez quelques personnes, le
cerveau est « lisse », dépourvu de circonvolutions ; chez d’autres, les circonvolutions existent, mais le cortex est
malformé. Vincent des Portes, Jamel Chelly et leurs collègues de l’Unité INSERM U129 ont découvert un gène
responsable de ce type de pathologies.
Au cours de l’embryogenèse*, les neurones qui ont cessé de se multiplier migrent. Beaucoup de neurones meurent au cours de
l’embryogenèse* ; c’est le cas de la moitié des neurones moteurs. Seuls subsistent ceux qui trouvent une cible (un autre neurone), les
autres dégénèrent. Lorsque les mécanismes d’apoptose* (le suicide des cellules) et de migration sont normaux, les neurones se
regroupent dans le cortex, tandis que la substance blanche, sous-corticale*, contient uniquement les axones, les prolongements des
corps cellulaires entourés de myéline (la myéline, qui participe à la conduction des signaux nerveux, donne à la substance blanche sa
couleur).
Parmi les rares enfants où les phénomènes de migration des neurones sont anormaux, les neuropédiatres des équipes de Jean-
Marc Pinard, à l’hôpital Raymond Poincaré, à Garches, et de Jacques Motte à Reims, ont décrit, grâce à l’imagerie par résonance
magnétique (IRM), un nouveau syndrome: dans une même famille, des garçons sont atteints de lissencéphalie* (le cortex est
dépourvu de circonvolutions) et des filles ont des hétérotopies* en bandes, ou double cortex. Dans cette dernière pathologie, le cortex
est apparemment normal, mais des bandes de substance grise, dites hétérotopiques, sillonnent la substance blanche (la substance grise
est constituée des corps cellulaires des neurones); au cours de l’embryogenèse, les neurones n’ont pas migré correctement et se sont
arrêtés avant d’atteindre leur but, au sein de la substance blanche. L’identification de plusieurs mutations génétiques dans les familles
atteintes a conduit l ‘équipe de l’INSERM à démontrer la responsabilité du gène dénommé Doublecortine dans ces pathologies*.
Les garçons ont un retard mental profond et des crises d’épilepsie réfractaires à tout traitement. Chez les filles, la variabilité est
extrême: certaines sont quasi asymptomatiques*, avec un retard mental léger, et une ou deux crises d’épilepsie dans l’enfance;
d’autres ont des symptômes aussi graves que les garçons.
Quelle est l’origine de cette variabilité ? La transmission exclusive par les mères à leurs enfants et la gravité des formes
affectant les garçons suggèrent une localisation du gène Doublecortine sur le chromosome X. Chez les garçons qui n’ont qu’un
chromosome X, les anomalies de migration (cortex lisse et trop épais) sont plus graves que chez les filles.
Ce gène code une protéine inconnue; c’est une protéine vraisemblablement intracellulaire qui ressemble, en partie, à une
protéine connue dont l’activité est régulée par la concentration en ions calcium. Bien que l’on sache que les ions calcium participent à
la migration des cellules et à l’apoptose*, on ignore encore les mécanismes physiopathologiques* déclenchés par les mutations du
gène Doublecortine.
Les hétérotopies* en bandes et les lissencéphalies* sont parfois héréditaires, mais nombre de ces maladies sont sporadiques*.
Elles sont transmises par une cellule de la reproduction mutée, le plus souvent par un spermatozoïde ayant subi une mutation aléatoire
sur le gène Doublecortine. Lorsqu’une fille hérite de cette mutation , elle n’a parfois qu’une mince bande de cortex hétérotopique
observée à l’IRM, mais peu de signes cliniques. En revanche, devenue adulte, elle risque d’avoir des garçons ayant une lissencéphalie
et des filles ayant des hétérotopies en bandes plus ou moins graves.
Connaissant ce nouveau gène du développement, les généticiens vont fabriquer des modèles animaux où le gène Doublecortine
sera inactivé. Ce nouveau gène sera un élément essentiel pour la compréhension des mécanismes de l’organisation du cortex. De
surcroît, la recherche des mutations potentielles que contient ce gène offrira un diagnostic moléculaire de la maladie. Un conseil
génétique pourra établir si les filles d’une famille atteinte portent ou non le gène muté, et un diagnostic prénatal sera offert aux
familles qui le souhaitent.
Pourtant, aux questions éthiques que pose tout diagnostic prénatal, s’ajoute la grave question du pronostic de la gravité de
l’atteinte chez les filles: si l’anomalie est toujours dramatique chez un garçon, chez une fille le handicap est parfois léger. On n’a
aucun moyen de prévoir la gravité de la maladie.
Apoptose : mort programmée des cellules
Asymptomatique : qui ne présente pas de symptôme particulier
Cognitive : qui concerne l’acquisition d’informations relatives à l’environnement de l’organisme
Embryogenèse : formation et développement de l’embryon
Hétérotopie en bandes : anomalie du cortex présentée dans le document 3
Lissencéphalie : anomalie du cortex présentée dans le document 2
Pathologie : maladie, anomalie de fonctionnement
Physiopathologique : relatif à des troubles du fonctionnement de l’organisme
Sous-corticale : située en dessous du cortex
Sporadique : apparaissant çà et là, de façon irrégulière

Questions
1. Dégagez les phénotypes macroscopiques des deux anomalies (lissencéphalie et hétérotopie).
2. Indiquez les anomalies du cortex, visibles sur les documents joints, à l’origine de ces phénotypes.
3. Indiquez les arguments qui ont permis de conclure à une origine génétique de ces anomalies d’une part, et de préciser la
localisation du gène en cause d’autre part.
4. Indiquez l’intérêt d’étudier le gène en cause.
document 1: coupe horizontale d’un
cerveau normal
AVANT
ARRIERE
Substance grise
Substance blanche
ventricule
Noyaux gris de
la base
ventricule
Substance grise
Substance blanche
Bandes de substance grise dans la
substance blanche
AVANT
ARRIERE
HAUT
BAS
document 2: coupe horizontale d’un
cerveau présentant une lissencéphalie.
Document « pour la science » n°244
document 3: coupe verticale d’un
cerveau présentant une hétérotopie en
bandes.
Document « pour la science » n°244
1
/
4
100%