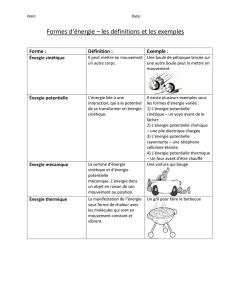
I. Quels sont les effets du travail d`une force

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Première S
Chapitre 7 Travail et énergie interne.
On a vu dans les chapitres précédents, que le travail d’une force pouvait modifier l’énergie cinétique
et/ou l’énergie potentielle de pesanteur d’un objet.
Quels sont les autres effets du travail d’une force ?
Ces effets permettent-ils de définir une autre énergie ?
I. Quels sont les effets du travail d’une force ?
1. Exemple d’un transfert d’énergie par travail de la force poids.
http://physiquecollege.free.fr/_private/troisieme/energie/conse
rvation_energie_mecanique.htm
L’énergie potentielle du départ se transforme en énergie
cinétique par travail de la force poids.
L’énergie potentielle se transforme par travail de la force
poids en énergie cinétique et inversement. L’énergie du
système est conservée.
2. Exemple d’un transfert d’énergie par travail d’une force de traction.
Le ressort du flipper (pub orangina) :
•
Dans l’état 1, le ressort est au repos, E
C
(1) = 0.
•
Le joueur exerce une force sur le ressort, son point d’application se
déplace : il exerce un travail.
•
Pourtant dans l’état 2, le ressort est de nouveau immobile et E
C
(2) = 0.
Qu’est donc devenu le travail fournit par le joueur ?
Un travail permet de déformer le ressort, et donc de stocker de
l’énergie dans celui-ci (l’énergie appelée énergie élastique est restituée étape c).
3. Exemple d’un transfert d’énergie par travail de la force de frottement.
Vidéo « meuleuse » : Le travail des forces de frottements entre le disque et la meuleuse provoque une
augmentation de température des 2 objets. L’énergie de la plaque (ou de la meuleuse) augmente.
L’énergie cinétique microscopique (les molécules se déplacent plus) augmente : on l’appelle aussi
énergie thermique.
Le ski : Lors du passage des skis sur la neige, les frottements peuvent être
responsables de la fusion de la glace sous la semelle des skis.
Le travail des forces de frottements peut provoquer une augmentation de
température ou un changement d’état.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
II. Les énergies.
1. L’énergie interne.
Les énergies cinétique et potentielle étudiées dans les chapitres précédents sont liées à des
modifications macroscopiques du système étudié : la vitesse pour l’énergie cinétique, la position par
rapport à la Terre pour l’énergie potentielle de pesanteur.
Les changements repérés dans les situations précédentes mettent en jeu des transformations
microscopiques « à l’intérieur du système ». On parle alors d’énergie interne.
Ainsi une augmentation de la température traduit un accroissement de l’agitation moléculaire et donc
modification de l’énergie cinétique microscopique.
Lors de la déformation d’un ressort, il y a modification des interactions microscopiques entre les
particules et onc modification de l’énergie potentielle microscopique.
Les diverses formes d’énergie stockées dans le système, en dehors de l’énergie cinétique et de
l’énergie potentielle d’interaction, constituent l’énergie interne du système, notée U exprimée en
Joules (J).
2. Les différentes énergies.
Sous la dénomination d’énergie interne, on trouve différentes formes d’énergie pouvant être stockées
par un système :
• énergie thermique : énergie cinétique microscopique des particules.
• énergie élastique : énergie potentielle microscopique liée aux forces d’interactions entre les
molécules (ou autres articules).
• énergie chimique : énergie potentielle microscopique liée aux forces d’interaction entre les
atomes (à l’intérieur es molécules).
• énergie nucléaire : énergie potentielle microscopique liée aux forces d’interaction entre les
nucléons (à l’intérieur des noyaux des atomes).
III. Le transfert thermique.
1. Température et variation d’énergie.
On place un glaçon dans un verre d’eau. La température du glaçon augmente, son énergie interne
augmente. La température de l’eau diminue, son énergie interne a diminué. Il y a donc eu transfert
d’énergie. Ce transfert s’est fait sans l’intervention d’une force et donc sans travail.
Le travail n’est pas le seul mode de transfert de l’énergie d’un système à un autre.
Le transfert est lié à la différence de température entre les deux corps mis en contact, on parle alors de
transfert thermique.
Autre exemple, une tasse de café qu’on laisse à la température ambiante. Au cours
du temps, la température du café diminue.
Un transfert d’énergie s’effectue de la tasse de café vers le milieu extérieur.
La tasse
de café cède de l’énergie sous forme de chaleur, notée Q, au milieu extérieur.
Le transfert thermique se fait toujours du corps le plus chaud vers le corps le plus froid.
Remarque : le transfert thermique est aussi appelé chaleur.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
La quantité d'énergie Q ( en joule ) apportée à une masse m de liquide passant de la température Ti à
la température Tf est :
Q = m. c . ( Tf – Ti ) avec c: chaleur massique du liquide chauffé
m : masse en kg.
Pour l’eau par exemple : c(eau) = 4,18.10
3
J/kg/°C
2. Plusieurs modes de transfert thermique.
Conduction :
Microscopiquement, la température rend compte de l’agitation des particules d’un gaz ou d’un liquide.
Le transfert par conduction signifie que cette agitation se propage de proche en proche, de molécule
en molécule. Une molécule agitée agite sa voisine qui agite sa voisine … Il n’y a
pas de déplacement des molécules (ustensile de cuisine sur le feu).
Convection :
Au contraire ici, la température se propage par déplacement de molécule (casserole d’eau sur le feu).
IV. Transfert par rayonnement.
Le transfert thermique par rayonnement est le fait que l’énergie interne d’un
corps (et sa température) augmente sous l’effet d’un rayonnement (de même
type que la lumière, il peut être visible ou non (U.V) )
Sa particularité est qu’il peut se faire dans le vide.
Conclusion
On appelle énergie mécanique la somme de l'énergie cinétique macroscopique et la somme de
l'énergie potentielle macroscopique :
E
M
=
E
C +
E
P
L'énergie totale E du système est la somme de l'énergie mécanique et de l'énergie interne
microscopique :
E
=
E
M
+
U
mic
= E
C +
E
P
+ U
mic
1
/
3
100%