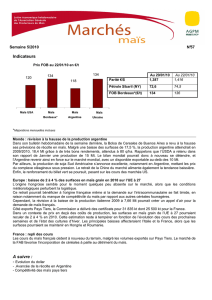
Dossier_B-FR-02-03

Demande d'autorisation pluriannuelle
pour dissémination volontaire de
plantes génétiquement modifiées :
DOSSIER TECHNIQUE
TESTAGE D’HYBRIDES DE MAÏS
GENETIQUEMENT MODIFIES
RESISTANTS AUX INSECTES COLEOPTERES
ET TOLERANTS A UN HERBICIDE
PIONEER GENETIQUE SARL

2
PREAMBULE
Le présent dossier de demande d’autorisation pluriannuelle pour la dissémination
aux champs de plantes de maïs génétiquement modifié est soumis dans le cadre de
la Directive 90/220 (et de la future Directive 2001/18).
Les informations contenues dans ce dossier sont liées à l’état d’avancement de la
recherche pour identifier l’événement de transformation qui sera éventuellement
mis sur le marché.
La dissémination envisagée concerne des essais de recherche à des fins
réglementaires qui doivent être effectués en Europe selon les principes directeurs
de la Directive 90/220. L’objectif de ces essais est de collecter des données sur la
composition analytique et l’expression des protéines produites par les plantes
génétiquement modifiées en comparaison avec les plantes équivalentes non
modifiées.

3
SOMMAIRE
INTRODUCTION..............................................................................................................5
A. INFORMATIONS GENERALES............................................................13
B. INFORMATIONS CONCERNANT L’ORGANISME
RÉCEPTEUR..............................................................................................................14
C. INFORMATIONS CONCERNANT LA MODIFICATION
GENETIQUE...............................................................................................................18
D. INFORMATION CONCERNANT LA PLANTE
SUPERIEURE GENETIQUEMENT MODIFIEE......................................19
E. CARACTERISATION DU SITE DE DISSEMINATION.............25
F. INFORMATION CONCERNANT LA DISSEMINATION.........26
G. INFORMATION SUR LES PLANS DE SURVEILLANCE,
DE CONTRÔLE ET DE TRAITEMENT DU SITE ET DES
DECHETS APRES DISSEMINATION...........................................................27
H. INFORMATION SUR LES ÉVENTUELLES INCIDENCES
DE LA DISSEMINATION DES PLANTES GÉNÉTIQUEMENT
MODIFIÉES SUR L’ENVIRONNEMENT....................................................29

4
INTRODUCTION
Cette demande d’essais aux champs porte sur du maïs génétiquement
modifié, par l’ajout de gènes issus d’une bactérie du sol, Bacillus
thuringiensis, pour résister à des insectes coléoptères ravageurs, les
chrysomèles des racines.
Les chrysomèles des racines du maïs causent chaque année des dégâts
énormes sur les récoltes en Amérique du Nord. Même si à l’heure actuelle
très peu de dégâts économiques liés à la chrysomèle des racines du maïs
ont été notés en Europe, cet insecte ne cesse de s’y développer dans les
zones où le maïs est cultivé. Il faut donc d’ores et déjà mettre en place un
système de lutte de façon à arrêter cette expansion.
1- Description et biologie de l’insecte
La chrysomèle des racines du maïs, insecte Coléoptère, est le principal
ravageur du maïs en Amérique du Nord (Etats-Unis, Canada) et cause
chaque année des pertes estimées à plusieurs millions de dollars. Les deux
principales espèces de chrysomèles des racines engendrant des
dommages économiques sont Diabrotica virgifera virgifera (chrysomèle
des racines, de l’ouest, figure 1), la plus agressive, et Diabrotica barberi
(chrysomèle des racines du nord, figure 2). La chrysomèle des racines du
maïs de l'ouest est jaune avec des bandes noires longitudinales sur les
ailes, alors que celle du nord est de couleur vert pâle.
Figure 1 : adulte de Diabrotica
virgifera virgifera
(source European and Mediterranean Plant
Protection Organization)
Figure 2 : adultes de Diabrotica
barberi

5
Les adultes pondent de petits oeufs blancs et ovales de moins de 0,1 mm
de longueur. Les oeufs hivernent dans le sol et commencent à se
développer au printemps quand la température du sol atteint 10 ou 11 °C.
Après leur émergence, les larves commencent à envahir les racines du
maïs à partir de la mi-juin. Les jeunes larves sont des vers minces et
cylindriques au corps blanc muni de six petites pattes situées juste derrière
la tête de couleur brune (figure 3). Les chrysomèles des racines du maïs
passent par trois stades larvaires (mues) avant de devenir adultes. Lorsque
leur développement est complet, les larves mesurent environ 1,5 cm.
Figure 3 : Larves de chrysomèles des racines du maïs au développement complet mesurant
1,5 cm de long; le corps est blanc, la tête et l'extrémité sont brunes.
(source Ministère de l’Agriculture, de l’Alimentation et des Affaires Rurales, Ontario)
Les larves de la chrysomèle des racines migrent dans le sol vers les
racines des jeunes plants de maïs. Elles se nourrissent de ces racines
(figure 4) pendant une période de 3 à 4 semaines jusqu'à ce que leur
développement soit complet à la mi-juillet environ.
Figure 4 : Larve de chrysomèle se nourrissant sur une racine de maïs (IPM/Entomology,
Department of Crop Sciences, University of Illinois).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%