cellules régulatrices en néphrologie et transplantation rénale

FLAMMARION
MÉDECINE
-
SCIENCES
—
ACTUALITÉS
NÉPHROLOGIQUES
2006
(www.medecine.flammarion.com)
CELLULES RÉGULATRICES EN NÉPHROLOGIE
ET TRANSPLANTATION RÉNALE
par
J. ZUBER*, S. CANDON**, F. FAKHOURI***,
E. THERVET* et Ch. LEGENDRE*
Longtemps controversée, l’existence des cellules T suppressives a été réétablie
au milieu des années 1990 sous la dénomination de lymphocytes T régulateurs.
Au cours de ces dernières années, elles ont fait l’objet d’un nombre exponentiel
de publications reflétant l’enthousiasme suscité. La raison de cet engouement est
double ; d’une part il témoigne d’une avancée très importante dans la compréhen-
sion du contrôle de la réponse immunitaire adaptative, d’autre part l’espoir d’une
manipulation sélective de cette sous-population lymphocytaire ouvre des perspec-
tives fascinantes en thérapeutique humaine. Ce chapitre n’abordera que les cellules
régulatrices dites canoniques, définies par le phénotype CD4+CD25fort et par
l’expression du gène FOXP3, auxquelles a été consacrée la grande majorité des
travaux.
CELLULES RÉGULATRICES Foxp3+
Généralités
En 1995 une population lymphocytaire CD4+CD25fort, pourvue de propriétés
régulatrices, est décrite chez la souris [1]. Un contingent similaire est identifié quel-
ques années plus tard chez l’homme [2]. L’expression de la molécule CD25 (chaîne
α du récepteur de l’IL-2) n’est pas spécifique des lymphocytes régulateurs, car elle
est partagée du moins transitoirement par tout lymphocyte T activé. La molécule
de co-stimulation inhibitrice CTLA-4, le TGF-β membranaire, le récepteur GITR,
* Service de Transplantation rénale, Hôpital Necker-Enfants malades ; ** Université René
Descartes, Paris 5, Service d’Immunologie Biologie et unité INSERM U580, Hôpital Necker-Enfants
malades ; *** Service de Néphrologie, Hôpital Necker-Enfants malades, Paris.

164 J. ZUBER ET COLL.
la neuropiline 1 et l’intégrine CD103 sont également exprimés par cette population,
mais n’en sont pas plus spécifiques. L’identification récente du gène FOXP3, qui
est électivement exprimé par cette population constitue donc un progrès décisif
pour sa caractérisation et son étude [3-6]. Les mécanismes immunomodulateurs
sous-tendus par le facteur de transcription Foxp3 ne sont que partiellement élucidés,
mais il semblerait qu’il ait la capacité de se lier à certains composants de la famille
Rel, tels que NFAT et NFκB, et d’en inhiber l’activité transcriptionnelle (IL-2, IL-4,
IFN-γ) [7].
Le rôle physiologique des cellules régulatrices CD4+CD25fort et leurs impli-
cations en pathologie sont multiples. Elles ont d’abord été impliquées dans le
contrôle des lymphocytes réactifs aux antigènes du soi [1] et à la flore bactérienne
du tube digestif [8]. Elles participent au maintien homéostatique des différents
compartiments lymphocytaires T [9-11] et B [12]. Elles contribuent enfin à la
modulation de réponses immunitaires aussi diverses que celles rencontrées en
transplantation allogénique [13], au cours de la grossesse [14], de la réponse anti-
tumorale [15], de l’allergie [16], et des infections [17].
Ontogénie et homéostasie des cellules régulatrices
CD4+CD25fort Foxp3+ (fig. 1)
En situation physiologique, l’export thymique contribue majoritairement à la
constitution du compartiment lymphocytaire périphérique Foxp3+. Il a récemment
été montré que l’orientation de thymocytes humains vers la lignée des cellules T
régulatrices est déterminée par leur interaction avec les cellules dendritiques des
corpuscules de Hassall [18]. Ces dernières, activées au contact de l’épithélium
médullaire par la molécule TSLP, présentent le complexe HLA-peptide et expri-
ment fortement les molécules CD80 / CD86. Elles permettent ainsi l’engagement
du TCR et de la molécule CD28 du thymocyte, condition indispensable à l’onto-
génie de la cellule régulatrice Foxp3+ [19]. L’importance du signal transmis par le
TCR est confortée par le déficit spécifique en cellules régulatrices observé chez
les animaux déficients pour un des composants de la voie de signalisation de NFκB
en aval du TCR (PKC-θ-/-, BCL-10-/-, IKK2-/-) [20].
Les signaux impliqués dans l’homéostasie de la population régulatrice en péri-
phérie (rate, ganglion) sont moins bien connus. Ils semblent dépendre de la sécré-
tion d’IL-2 par les autres lymphocytes [21, 22], ainsi que d’interactions entre le
TCR des cellules régulatrices et leur ligand antigénique [23]. L’engagement de la
molécule de co-signal CD28 de la cellule régulatrice par son ligand B7 est égale-
ment indispensable à son maintien en périphérie [24].
Adressage, expansion et mode d’action (voir fig. 1)
La compréhension des mécanismes déterminant l’adressage des cellules régu-
latrices est un enjeu majeur dans une perspective de modulation thérapeutique de
la réponse suppressive. Le couple chimiokine-récepteur CCL21/CCR7 et l’expres-
sion de la molécule CD62L sont nécessaires à l’entrée de la cellule régulatrice
dans le ganglion drainant [25], passage requis à son expansion. Le récepteur CCR4,
exprimé constitutivement par la population CD4+CD25fort Foxp3+ [26], a montré
son importance dans la réponse à l’effet chimiotactique de la molécule CCL22

CELLULES RÉGULATRICES EN NÉPHROLOGIE ET TRANSPLANTATION RÉNALE 165
(MDC). Cet axe chimiotactique est notamment associé au recrutement préférentiel
des cellules Foxp3+ dans le carcinome de l’ovaire chez l’homme [27] et dans un
modèle de tolérance allogénique chez la souris [28]. Enfin, l’intégrine CD103
(αEβ4), exprimée par les cellules Foxp3+, permet leur rétention dans les épithé-
liums, en particulier cutané et digestif [8, 29].
In vivo, les capacités de prolifération et d’expansion des cellules régulatrices
sont très importantes, contrastant avec les observations d’anergie in vitro [30, 31].
La prolifération est spécifique d’antigène et siège dans le ganglion drainant. Cer-
taines cellules dendritiques, activées en milieu pro-inflammatoire, sont capables
de faire proliférer les cellules régulatrices tout en annihilant leur effet suppressif
[30]. D’autres au contraire, immatures et exprimant le TGF-β, favorisent la réponse
suppressive en soutenant électivement leur expansion [32]. La capacité à stimuler
la réponse suppressive, sans activer la réponse effectrice, constitue sans doute une
des propriétés fondamentales des cellules dendritiques dites tolérogènes.
Les mécanismes de suppression de la cellule régulatrice Foxp3+ sont pluriel. In
vitro, ils sont exclusivement dépendant d’un contact cellulaire et reposent sur
l’effet immunomodulateur des molécules CTLA-4 et TGF-β [33]. Une des consé-
quences fonctionnelles majeures de l’effet suppressif est l’inhibition de la sécrétion
d’IL-2 par les cellules effectrices [34]. Par ailleurs, la molécule CTLA-4 agit en
induisant l’expression de l’enzyme indoléamine 2,3 di-oxygénase (IDO) dans la
cellule présentatrice d’antigène (CPA) [35]. L’IDO consomme le tryptophane
Foxp3
Foxp3
LT
Foxp3
Foxp3
Foxp3
Foxp3
THYMUS
médullaire
TUBE DIGESTIF
IL-10
CD103
TGF-β
TUMEUR
GREFFE
TOLÉRÉE
TGF-β
LT
LT
LT
LT
LT
LT
LT
LT
LT LT
CTLA-4
CCL22
CCR4
Foxp3 Foxp3
Foxp3
Foxp3
Foxp3
Foxp3
Foxp3
Foxp3
Foxp3
Foxp3
α4β7
CCR9
CD103
CCL19/21
GANGLION
CD CD103
CD
pro-inflammatioire
CD Tolérogène
CCR7
CD62L
Cortex IL-2
CD28
TSLP TCR
Corpuscule d’Hassall
AUTO-IMMUNITÉ
REJET
RÉPONSE ANTI-
INFECTIEUSE
EFFICACE
–
FIG. 1. — Ontogénie thymique et circulation périphérique des cellules régulatrices
CD4+CD25fort Foxp3+. Abréviations : CD, cellules dendritiques ; LT, lymphocytes T.

166 J. ZUBER ET COLL.
essentiel à la prolifération lymphocytaire. Un mode d’action impliquant une inte-
raction directe avec la cellule effectrice a également été démontré [36]. Enfin, in
vivo, la sécrétion d’IL-10 par la cellule régulatrice, lui confère un effet suppressif
à distance (effet by-stander) [10].
Rôle des cellules régulatrices en pathologie humaine
CAS PARTICULIER DU SYNDROME IPEX
Le syndrome IPEX (immune dysregulation polyendocrinopathy enteropathy
X-linked) qui affecte exclusivement les garçons est lié à une mutation du gène
FOXP3, situé sur le chromosome X [37]. Celui-ci est spontanément muté chez la
souris Scurfy dont les symptômes miment la maladie humaine [38]. Le rôle déter-
minant du gène FOXP3 dans le développement et la fonction des cellules régula-
trices suggère l’absence de ces cellules chez les enfants IPEX comme chez leur
homologue murin [3, 4]. À cet égard les manifestations cliniques du syndrome
IPEX illustrent la situation caricaturale d’un déficit complet en cellules régulatrices
Foxp3+. Révélée dans les premiers mois de vie, la maladie se traduit classiquement
par une maladie inflammatoire de l’intestin responsable d’une diarrhée profuse,
un diabète, une thyroïdite, et autres maladies auto-immunes, auxquelles s’associent
souvent des manifestations atopiques (eczéma, hyper-IgE) et plus rarement un
syndrome lymphoprolifératif [39]. L’évolution est rapidement fatale en l’absence
de traitement par allogreffe de moelle [40], alternative à un traitement immuno-
suppresseur lourd [39].
RUPTURE DE TOLÉRANCE
Bien sûr, la plupart des maladies auto-immunes ne répondent pas à une équation
monogénique aussi simple que celle du syndrome IPEX et s’inscrivent plus volon-
tiers dans un contexte multifactoriel, polygénique et environnemental. Néanmoins,
il est possible qu’un déficit partiel, quantitatif ou fonctionnel, des cellules régula-
trices participent à la physiopathologie de diverses maladies auto-immunes. Ainsi,
un déficit des capacités fonctionnelles des cellules suppressives a été mis en évi-
dence dans le syndrome poly-auto-immun glandulaire de type II [41], la polyarth-
rite rhumatoïde [42], la sclérose en plaques [43] et la myasthénie associée aux
thymomes [44].
La défaillance de cette population est enfin impliquée dans les manifestations
atopiques précoces [45] et les entéropathies inflammatoires [46].
GAIN DE TOLÉRANCE
Si l’acquisition ou la restauration d’un état de tolérance immunologique consti-
tue un objectif phare en transplantation et au cours d’affections auto-immunes, elle
peut au contraire être délétère dans la réponse contre les agents infectieux et cel-
lules tumorales. Ainsi certains pathogènes, en particulier viral (VIH [47]) et para-
sitaire (leishmaniae [48], plasmodium [49]), semblent échapper à une réponse
immunitaire efficace par le recrutement et l’expansion préférentielle des cellules
régulatrices Foxp3+. Les mécanismes engagés sont très largement méconnus.
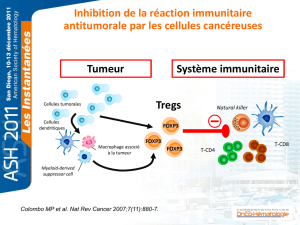
La mise en cause des cellules régulatrices dans l’anergie du système immunitaire
vis-à-vis des cellules cancéreuses les place au centre des nouvelles stratégies

CELLULES RÉGULATRICES EN NÉPHROLOGIE ET TRANSPLANTATION RÉNALE 167
d’immunothérapie anti-tumorale. Les cellules régulatrices seraient recrutées au siège
de la tumeur par la chimiokine CCL22 (MDC), dont elles expriment le récepteur
CCR4 [27]. Des cellules dendritiques immatures sécrétant du TGF-β favoriseraient
leur expansion préférentielle entravant la réponse cytotoxique [32]. L’efficacité
d’une déplétion de ces cellules par anticorps anti-CD25, anti-CTLA-4 et anti-GITR
[50] dans le traitement de cancers murins ouvre des perspectives thérapeutiques fas-
cinantes. Des protocoles similaires, associés ou non à une vaccination anti-tumorale,
sont à l’étude chez l’homme, notamment dans le traitement du mélanome [51].
CELLULES RÉGULATRICES EN NÉPHROLOGIE
Atteinte rénale au cours du syndrome IPEX
Les néphropathies développées au cours de l’IPEX ont été décrites par R. Habib
au début des années 1990 [52]. Le syndrome est alors surtout caractérisé par son
atteinte digestive, constante et souvent révélatrice, l’entéropathie auto-immune [53].
C’est seulement dix ans plus tard que l’identification d’une mutation du gène
FOXP3 dans la forme sévère liée à l’X, la plus fréquente, permet de définir un sous-
groupe de patients, atteints du syndrome dénommé IPEX [53]. L’entéropathie auto-
immune se définit par une entérite diffuse touchant grêle et côlon, la résistance au
régime sans gluten et l’incidence élevée de maladies auto-immunes associées. La
présence d’anticorps anti-entérocytes reflète la nature auto-immune de l’affection.
L’atteinte rénale est fréquente et certainement très sous-estimée au cours de l’IPEX,
occultée par le sévérité de la présentation [39]. Deux types de néphropathies, asso-
ciées ou non, sont décrites : des néphrites tubulo-interstitielles révélées par un syn-
drome de Fanconi, et des glomérulonéphrites extramembraneuses (tableau I [52]).
Lorsque le sérum est étudié en immunofluorescence indirecte sur coupe de rein
normal, il contient toujours un anticorps dirigé contre les cellules tubulaires proxi-
males et /ou un constituant de la membrane basale tubulaire. L’adsorption du sérum
sur une coupe digestive négative parfois la fluorescence sur le rein, suggérant un
déterminant antigénique commun. Certaines cibles antigéniques ont été purifiées
dans les lysats de membrane basale tubulaire et cellules épithéliales (tubulaires et
villositaires). On compte parmi elles des protéines de 75 [54], 58 et 55 kDa. L’auto-
anticorps dirigé contre l’AIE-75, est spécifique des entéropathies auto-immunes
compliquées d’atteinte rénale [54]. Cette protéine est distribuée de façon prédomi-
nante sur les cellules épithéliales de la lumière digestive et tubes rénaux proximaux.
L’observation d’une jeune femme, prise en charge pour une insuffisance rénale
associée à un syndrome de Fanconi complet, nous a permis de caractériser le pre-
mier cas de déficit sévère en cellules régulatrices Foxp3+ non lié à une mutation
du gène FOXP3 [55]. Issue d’une famille consanguine, cette jeune femme était
suivie depuis l’âge de 10 ans pour un désordre immunitaire associant infections
récidivantes et syndrome poly-auto-immun. Révélée par une érythroblastopénie,
la maladie s’est manifestée successivement par une gastrite, un vitiligo, une enté-
ropathie auto-immune, une hépatite et enfin une néphrite tubulo-interstitielle.
L’auto-anticorps anti-AIE75 était présent, confirmant la réactivité du sérum de la
patiente avec les bordures en brosse des cellules tubulaires proximales et villositaires
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%


![Poster CIMNA journée CHOISIR [PPT - 8 Mo ]](http://s1.studylibfr.com/store/data/003496163_1-211ccc570e9e2c72f5d6b6c5d46b9530-300x300.png)
![Pene_GrrrOH_02072015 - public [Mode de compatibilité]](http://s1.studylibfr.com/store/data/001230682_1-f593ab7310c23a44db266019e9363fd7-300x300.png)




