Whipple (maladie de)

Whipple (maladie de)
La maladie de Whipple aété décrite par George
Whipple en 1907 chez un homme de 36 ans sous le
nom de «lipodystrophie intestinale ». L’origine bacté-
rienne de cette maladie était déjà suspectée du fait de la
présence de bâtonnets prenant la coloration argentique
dans les cellules de l’intestin grêle malade. Alors qu’elle
était d’évolution fatale en 5à20ans, cette maladie a
pu être traitée avec succès par antibiothérapie dès les
années 1950. Les bâtonnets ont été identifiés comme
des bactéries en microscopie électronique en 1961, et
en 1992, les techniques de biologie moléculaire ont per-
mis de décrire une nouvelle espèce bactérienne, appa-
rentée aux bactéries àGram positif àhaut contenu en
guanine et cytosine et plus particulièrement aux actino-
mycétales, sous le nom de Tropheryma whippelii puis
Tropheryma whipplei.Laculture de la bactérie n’a été
réalisée qu’en 2000 sur une lignée de cellules fibro-
blastiques humaines. Elle croît très lentement (temps de
doublement 17 jours) et jamais sur milieu axénique.
T. whipplei n’est pas systématiquement pathogène.
C’est une espèce bactérienne qui peut être retrouvée
dans l’environnement, et plus précisément dans l’eau.
Elle apuégalement être retrouvée chez des patients
sains, en particulier au niveau de la salive et du liquide
gastrique. La pathogénie de l’infection est caractérisée
par une infiltration massive des tissus atteints par des
macrophages PAS+ colorés par l’acide périodique de
Schiff (PAS) et correspondant àl’accumulation de bac-
téries phagocytées ou de débris bactériens, dans le cadre
d’un déficit de l’immunité cellulaire peut-être spéci-
fique. La plus grande fréquence du groupe tissulaire
HLA-B27 (28 %), la forte prédominance masculine
(80 %) et une répartition mondiale des cas très hétéro-
gène (prédominance caucasienne) suggèrent la respon-
sabilité d’un terrain génétique favorable.
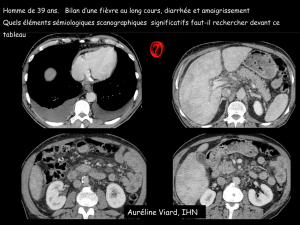
La maladie de Whipple atteint plutôt l’homme d’âge
moyen (35–65 ans) de race blanche et se caractérise
principalement par une perte de poids associée àdes
arthralgies, àune diarrhée chronique et àdes douleurs
abdominales. Une fièvre au long cours avec sueurs noc-
turnes est souvent présente, parfois associée àdes
adénopathies. La séquence arthralgies chroniques,
intermittentes, migratoires, non destructrices, séro-
négatives, puis diarrhée puis perte de poids, qui peut
s’étaler sur plusieurs années (en moyenne 8ans), est très
en faveur d’une maladie de Whipple. Les manifestations
cliniques liées au syndrome de malabsorption sont
présentes tardivement :stéatorrhée, anémie, hypo-
albuminémie, hypocalcémie. D’autres organes peuvent
être concernés, parfois isolément :cœur (endocardites),
système nerveux central (ataxie, démence, etc.), œil
(uvéite), poumon (toux chronique). L’absence d’atteinte
digestive, dans 15 à20%des cas, ou le début par une
atteinte neurologique pure peuvent compliquer le diag-
nostic.
Le traitement repose sur l’utilisation de triméthoprime-
sulfamétoxazole (Bactrim
®
), avec une correction de la
diarrhée en quelques jours, des atteintes articulaires en
1mois. Les rechutes sont fréquentes malgré une durée
préconisée du traitement de 6mois à1an.
Le diagnostic biologique reposait encore récemment
uniquement sur l’histologie et sur la présence d’une
infiltration macrophagique PAS+ sur une biopsie duo-
dénale basse. Cette recherche est préconisée même en
absence de signes digestifs. Seules trois autres situations
cliniques peuvent permettre de rencontrer ce type
d’infiltration :infection àMycobacterium avium-
intracellulare chez un patient atteint de sida,
histoplasmose systémique et macroglobulinémie.
L’utilisation d’une PCR spécifique permet maintenant
de détecter l’ADN de T. whipplei dans les tissus ou le
sang périphérique, en amplifiant de façon spécifique le
gène de l’ARN ribosomique 16S, la région intergénique
16S-23S ou le gène RpoB.
Le prélèvement àtester sera choisi en fonction du
contexte clinique :biopsie duodénale le plus souvent et
toujours en cas de signes digestifs, LCR en cas de signes
neurologiques isolés, liquide ou biopsie synoviale en cas
d’atteinte articulaire, biopsies autres. L’association de
la recherche par PCR àl’histologie permet de gagner en
sensibilité et en spécificité ;eneffet, T. whipplei apu
être retrouvé dans l’eau et dans la salive ou le liquide
gastrique de patients sains. L’interprétation d’une posi-
tivité isolée en PCR demandera donc beaucoup de pru-
dence. L’ADN bactérien peut être retrouvé dans les
leucocytes du sang périphérique, mais cette détection
n’est pas systématique, malgré la diffusion systémique
de la bactérie. La PCR peut rester négative dans le sang
malgré sa positivité dans différents organes. Cette néga-
tivité ne permet donc pas d’éliminer àelle seule une
suspicion de maladie de Whipple, et la recherche
d’ADN de T. whipplei dans le sang n’est préconisée
qu’en association àune recherche tissulaire.
Il n’existe pour l’instant pas de test sérologique dispo-
nible.
(ColletC,Sanson Le Pors MJ, Raskine L.
Trophyrema Whipplei. Aspects cliniques et biologiques.
Feuillets Biol2004 ;45/257 :11-19.
MarthT,Raoult D.
Whipple’s disease.
Lancet 2003 ;361 :239-246.
1
/
1
100%