Roˆ le des prostaglandines dans le cancer colorectal

Ro
ˆle des prostaglandines
dans le cancer colorectal
Role of prostaglandins in colorectal cancer
Rachid Zagani,
Nadim Hamzaoui,
Dominique Lamarque
Institut national de la sante´
et de la recherche me´ dicale U567,
Centre national de la recherche
scientifique (UMR 8104), institut Cochin,
universite´ Paris-Descartes,
24, rue du Faubourg-Saint-Jacques,
75014 Paris, France
Re
´sume
´.Le cancer colorectal (CCR) est une cause majeure de décès liés au cancer. Les anti-
inflammatoires non stéroïdiens et les coxibs, inhibiteurs sélectifs de cyclo-oxygénase-2 (Cox2),
ont montré un effet majeur dans l’inhibition de la tumorogenèse et dans la prévention du CCR
chez l’homme et la souris. Plusieurs études récentes ont montré que le produit bioactif de
Cox2, la prostaglandine E2 (PGE2), active les récepteurs (EP), en induisant l’activation de plu-
sieurs voies de signalisation impliquées dans la progression tumorale du CRC. Cette revue
décrit la connexion entre ces différentes voies de signalisation dont la compréhension pourrait
nous permettre de développer de nouveaux médicaments pour traiter et/ou prévenir le CCR.
Mots cle
´s:cancer colorectal, prostaglandine
Abstract.Colorectal cancer (CRC) is a leading cause of cancer-related deaths worldwide.
Classical non-steroidal anti-inflammatory drugs and coxibs, selective inhibitors of cyclo-
oxygenase-2 (Cox2), were highly effective in inhibiting tumor growth and preventing CRC in
humans and in mice models. Recent reports show that one of the bioactive products of Cox2,
prostaglandin E2, activate, after binding to its receptors, multiple intracellular pathways invol-
ved in colorectal tumorigenesis. The findings reviewed here reveal important crosstalks bet-
ween these pathways, which could provide opportunities for the development of new drugs
for the treatment and prevention of CRC.
Key words : colorectal cancer, prostaglandin
L
e cancer colorectal (CCR) est
le deuxième cancer en termes
d’incidence chez l’homme
(après le cancer bronchopulmo-
naire) et la femme (après le cancer
de sein), en France. Il tue environ
60 000 personnes par an aux
États-Unis.
La cancérogenèse colorectale met
en jeu un processus multi-étapes
fait de modifications génétiques et
moléculaires, induisant des modifi-
cations histologiques, amenant à la
formation d’un adénome puis d’un
adénocarcinome. Ce processus
séquentiel de cancérogenèse est
lent et implique différentes voies de
signalisation offrant des possibilités
de développer des stratégies molé-
culaires ciblées préventives et curati-
ves. L’utilisation de médicaments
capables de prévenir le développe-
ment des adénomes et des cancers
suscite un intérêt croissant.
De nombreuses études épidémiolo-
giques ont montré une réduction de
40 à 50 % du risque de développer
un CCR chez les patients consom-
mant régulièrement de l’aspirine ou
des anti-inflammatoires non stéroï-
diens (AINS) [1]. Plus récemment,
trois études randomisées contre pla-
cebo ont mis en évidence une dimi-
nution du risque d’apparition d’adé-
nomes dans des populations ayant
un risque modéré de développer
des adénomes et traitées par aspi-
rine [2-4]. L’aspirine est un inhibiteur
irréversible du site actif de cyclo-
oxygénase (Cox). Il modifie le site
de liaison de substrat par l’acétyla-
tion d’un résidu sérine, ce qui empê-
che la fixation de l’acide arachido-
nique (AA). Cependant, les AINS,
comme l’indométacine, le piroxi-
cam, l’ibuprofène et le sulindac,
exercent leur effet inhibiteur via la
fixation au site de liaison de substrat
doi: 10.1684/hpg.2009.0295
Tirés à part : N. Hamzaoui
137
He
´pato-Gastro, vol. 16, n°2, mars-avril 2009
Mini-revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

de la protéine Cox d’une façon non covalente. La
régression des polypes adénomateux sous sulindac,
chez des patients atteints de PAF, a été décrite sous
forme de cas cliniques en 1983 et en 1989 [5, 6].
Ces résultats ont été confirmés par des études randomi-
sées utilisant le sulindac [7-9]. En parallèle, des modè-
les murins de la PAF ont permis de confirmer que des
AINS classiques, comme le piroxicam [10] ou le sulin-
dac [11, 12], inhibaient le développement des polypes.
En 1994, Eberhart et al. étaient les premiers à démon-
trer que les adénomes et les adénocarcinomes présen-
tent un niveau d’expression de Cox2 très élevé par
rapport à celui de Cox1 [13]. Deux ans plus tard, en
1996, Oshima et al. avaient démontré le rôle spéci-
fique de Cox2 dans la prolifération tumorale en utilisant
les souris APC
Δ716
, dont l’expression de Cox2 était
invalidée. En effet, ces auteurs constataient une réduc-
tion de 66 % du nombre de polypes chez les souris
ayant une seule copie du gène Cox2 et de 86 % chez
les souris où le gène était complètement invalidé, com-
parées aux souris témoins. Cette étude a permis, en
outre, de démontrer que l’expression de Cox2 était un
événement précoce dans la cascade d’événements de
la cancérogenèse colique, et que son taux augmentait
avec la perte du gène allèle sauvage APC au cours de
l’apparition de l’adénome [14].
Par ailleurs, l’inhibition de l’activité enzymatique de
Cox1 et Cox2 par les AINS suggère donc que l’effet
antitumoral de ces médicaments est dû partiellement à
l’inhibition de Cox2. La différence structurelle qui existe
entre Cox1 et Cox2 a été exploitée par l’industrie phar-
maceutique pour fabriquer des inhibiteurs sélectifs de
Cox2 connus sous le nom des coxibs. Ces inhibiteurs
ont montré une efficacité préventive et curative sur les
adénomes coliques chez l’homme et chez les modèles
animaux de PAF.
Voies me
´taboliques des Cox
Il existe deux isoformes de la Cox, respectivement
appelées Cox1 et Cox2. Cox1 est constitutivement
exprimée dans la quasi-totalité des tissus de l’orga-
nisme. Elle est responsable de la synthèse de prosta-
glandines (PG) impliquées dans des fonctions de l’ho-
méostasie, telles que la cytoprotection de la muqueuse
gastrique, la régulation de la fonction plaquettaire
ainsi que du débit sanguin rénal. À l’inverse, Cox2
est généralement indétectable dans la majorité des
organes. Néanmoins, son expression est fortement
inductible lors de l’inflammation ou de la stimulation
par des substances mitogènes [15].
Les Cox catalysent des réactions d’oxydation via leur
site Cox et des réactions de réduction via leur site pero-
xydase. Elles ont pour substrats les acides gras poly-
insaturés, particulièrement l’AA, élément constitutif
des membranes lipidiques libéré par hydrolyse des
phospholipides par la phospholipase A2 (PLA2).
L’activité des Cox est latente et requiert l’interaction du
site peroxydase avec des hydroperoxydes, permettant
la formation d’un composé peroxyde et sa conversion
en espèces radicalaires tyrosyl qui se lient à l’extrémité
du canal oxygénase en l’orientant vers le site de liaison
aux acides gras. Ainsi, en présence d’une quantité
adéquate d’AA et d’oxygène, une molécule de Cox
produit environ 10
3
molécules d’un composé hydro-
peroxyde : la prostaglandine G2 (PGG2) [16].
Cox2 catalyse la réaction d’oxydation de l’AA en
PGG2 via le site Cox, suivie d’une réaction de réduc-
tion de PGG2 via PGH2 grâce au site peroxydase.
L’activation de différentes enzymes de type isomérase,
synthase et réductase permet ensuite la conversion du
PGH2 en prostanoïdes. Ces prostanoïdes incluent les
PGD2 et PGE2 provenant de l’isomérisation de
PGH2, respectivement via les PGD et PGE synthases,
les prostacyclines PGI2 issues de la conversion de la
PGH2 par la prostacycline synthase, les isoprostanes
PGF2αrésultant de la réduction de la PGH2 ou de la
PGE2, les thromboxanes TXA2/TXB2 formés par la
conversion de la PGH2 par la TX synthase (TX-S) et
les cyclopentones, PGA2 et PGJ2, dérivant des PGE2
et des PGD2. La production d’un isotype particulier de
prostanoïde est sous le contrôle de la colocalisation des
différentes PG synthases avec les Cox et plus particuliè-
rement de la PG synthase la plus proche de la PGH2
produite par les Cox [17].
Ro
ˆle des PG
dans la tumorogene
`se colique
Nous avons vu que Cox2 permet la synthèse de prosta-
noïdes, incluant les PG/prostacyclines (PGE2, PGD2,
PGI2), les thromboxanes (TXA2), les cyclopentones
(PGA2, PGJ2) et les isoprostanes (PGF2α), mais aussi
la formation de malonaldéhyde (MDA, agent muta-
gène) et d’espèces radicalaires qui, libérées par la
réaction d’oxydation, permettent l’activation de carci-
nogènes. La synthèse de ces différents prostanoïdes sur-
vient quelques minutes après la libération de calcium
intracellulaire par les stimuli. Les effets biologiques
des produits de Cox2 sont transmis par l’activation de
récepteurs à sept domaines transmembranaires cou-
plés aux protéines G hétérotrimériques. Ces récepteurs
sont : DP pour le PGD2, EP (EP1, EP2, EP3 et EP4) pour
PGE2, FP pour PGF2α, IP pour PGI2 et TP pour TXA2.
Cependant, certaines PG et leurs métabolites exercent
leur fonction via la fixation aux récepteurs nucléaires
appartenant à la famille des PPAR (peroxisome prolife-
rator activated receptor) qui agissent directement
138 He
´pato-Gastro, vol. 16, n°2, mars-avril 2009
Mini-revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

comme facteurs de transcription après fixation du
ligand. En effet, il a été déjà décrit que la PGI2 transac-
tive le PPARδ[18], et que 15dPGJ2 est un ligand natu-
rel de PPARγ[19]. De plus, une étude récente démontre
que la PGE2 induit l’activation de PPARγ,d’une façon
indirecte, dans certains contextes [20].
Les prostanoïdes sont impliqués dans plusieurs proces-
sus physiologiques et physiopathologiques, comme la
modulation des réactions inflammatoires, la cytoprotec-
tion, l’ulcération gastro-intestinale, l’angiogenèse, la
cancérogenèse, l’homéostasie, la thrombose, l’hémo-
dynamique rénale et la progression des maladies réna-
les. Plusieurs travaux ont été réalisés pour étudier l’im-
plication directe de chaque PG dans le cancer colique.
La majorité de ces études montre que, par l’intermé-
diaire de PGE2, Cox2 exerce son effet protumoral, tan-
dis que le reste soutien le rôle des autres prostanoïdes
dans la cancérogenèse colique.
TXA2
Le TXA2 active les récepteurs TPαet TPβ,fonctionnelle-
ment couplés aux protéines G-hétérotrimériques Gαs,
Gαq, Gαi2 et Gα12/13. Les récepteurs TP sont activés
par le TXA2 et les isoprostanes pour transmettre les
signaux du stress oxydatif. Le TXA2 est surexprimé
dans les tissus tumoraux, péritumoraux et dans les gan-
glions lymphatiques par rapport à la muqueuse saine
[21]. Il est induit par les facteurs angiogéniques
(VEGF, FGFβ) et produit par les cellules endothéliales
microvasculaires humaines activées [22, 23]. Il joue un
rôle dans l’angiogenèse en induisant la migration des
cellules endothéliales [22]. L’inhibition de la transduc-
tion du signal, via le récepteur du TXA2 par l’antago-
niste SQ-29548, inhibe la migration des cellules endo-
théliales et l’angiogenèse induite par le FGF [23]. En
plus de son rôle établit dans l’athérogenèse, le TXA2
est impliqué dans le processus métastatique. L’inhibition
de la synthèse de TXA2 abolit l’invasion de carcinome
colique vers le foie et le développement des métastases
pulmonaires [22, 24]. Cependant, l’invalidation du
gène codant le récepteur TP n’affecte pas la formation
de cryptes aberrantes (ACF) induites par l’agent carcino-
gène azoxyméthane (AOM) [25]. Le rôle de TXA2 dans
la tumorogenèse intestinale n’étant pas bien établi, des
investigations supplémentaires sont nécessaires.
PGD2
La PGD2 constitue un signal anti-inflammatoire précoce
en supprimant l’infiltration des granulocytes dans la
cavité pleurale inflammatoire [26]. Le rôle de ce pros-
tanoïde dans le cancer colique n’est pas encore bien
défini. L’invalidation du gène codant la PGD2 hémato-
poïétique synthase, chez la souris APC
Min/+
, accélère
la croissance tumorale intestinale [27]. Cela suggère
que la PGD2 et/ou ces métabolites ont des effets non
transformants. Cependant, le traitement avec AOM
induit la formation de tumeur colique chez des souris
n’exprimant pas le récepteur DP [25]. Cela confirme
le rôle suppresseur de tumeur de PGD2. Afin d’expli-
quer ces hypothèses, Wang et Dubois proposent que
la PGD2 exerce son effet biologique par l’intermédiaire
des récepteurs DP et/ou PPARγ. La PGD2 pourrait être
métabolisé en 15dPGJ2, ligand endogène de PPARγ.
La PGD2 exerce alors son effet antitumoral via la voie
de PPARγ. Ainsi, l’activation de cette voie abolit la
croissance tumorale par l’induction de la différentiation
cellulaire ou l’apoptose et l’inhibition de la prolifération
cellulaire. Une autre explication alternative repose sur
la forte expression de PGD2 synthase qui pourrait
dévier la conversion de PGH2 en PGE2 (effet protumo-
ral) au profit de PGD2 (effet suppresseur de tumeur
[28]).
PGF2α
Les isoprostanes PGF2αsont des analogues des PG for-
més par les Cox ou par action directe de radicaux
libres sur l’AA [29]. Différents agents pro-
inflammatoires (TNF-α, IL1-β,INF-γet LPS) activent la
formation des PGE2 et de l’isoprostane 8-iso-PGF2α
par les plaquettes et les monocytes via les Cox [30].
L’isoprostane 8-épi-PGF2αest augmentée dans les
situations expérimentales ou cliniques et le stress oxy-
datif induit par la fumée de cigarette [31]. C’est un
vasoconstricteur par un mécanisme dépendant des
flux calciques et de la PKC [32]. Le 8-épi-PGF2αest
un agoniste partiel du récepteur TP et se lie à son pro-
pre récepteur FP couplé à Gαq et à la production d’ino-
sitols triphosphates IP3 et à la synthèse de l’ADN dans
le muscle lisse vasculaire [33, 34]. Une étude in vitro
sur un carcinome colique a démontré que la PGF2α
n’induit pas la prolifération cellulaire ; de plus, la délé-
tion du gène codant le récepteur FP n’affecte pas la
tumorogenèse colique induite par l’AOM. Cela
implique que la PGF2αn’a pas un rôle indispensable
dans la progression colorectale colique [25, 35].
PGI2
Dans les conditions physiologiques, PGI2 est le produit
majoritaire de Cox1 au niveau des tractus gastro-
intestinaux, accomplissant un rôle cytoprotecteur contre
le mucus gastro-intestinal. Au cours des processus phy-
siopathologiques, la PGI2 exerce sa fonction de média-
teur de l’inflammation aiguë et chronique. L’implication
de PGI2 dans le cancer du côlon n’est pas totalement
éclairée. En effet, le récepteur IP ne contribue pas au
développement tumoral induit par l’agent mutagène
AOM [25], tandis que la PGE2 active PPARδdans un
modèle cellulaire de carcinome colique [36]. Le PPARδ
139
He
´pato-Gastro, vol. 16, n°2, mars-avril 2009
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

activé accélère la croissance des adénomes chez la
souris APC
min
[18], suggérant que la PGI2 participe à
la progression tumorale colique par l’intermédiaire du
récepteur PPARδ. Donc, l’implication de la PGI2 dans
le cancer du côlon nécessite d’explorer le rôle de PGI2
et de son récepteur IP dans la carcinogenèse colique.
PGE2
PGE2 constitue le principal produit dérivé des Cox pré-
sent au site de l’inflammation [37]. Elle joue le rôle de
médiateur de l’inflammation en augmentant la perméa-
bilité vasculaire et la contraction ou la dilatation du
muscle lisse. De plus, elle sensibilise les terminaisons
périphériques des nocirécepteurs, entraînant une
hypersensibilité locale à la douleur. Elle est le produit
de la PGE2 synthase (PGES) qui existe sous deux for-
mes : cytosolique (cPGES) et membranaire (microsomal
mPGES). L’activité des mPGES et leurs expressions sont
augmentées par les stimuli pro-inflammatoires dans les
adénomes et les CCR humains [38]. Les mPGES, colo-
calisés avec les Cox au niveau de la membrane périnu-
cléaire, sont préférentiellement couplés à Cox2, notam-
ment en présence d’une quantité limitée d’AA [39].
Les cellules, cotransfectées de manière stable avec les
ADNc codant Cox2 et mPGES, sont transformées, pro-
lifèrent plus vite, sont hautement agrégées et forment
des tumeurs chez la souris athymique, suggérant que
PGE2 est un médiateur des effets transformants de
Cox2 [39, 40]. Cox2 est associée à un haut niveau
de PGE2 dans les tumeurs de la tête et du cou, et son
inhibition par le célécoxib ou par l’utilisation d’un anti-
corps neutralisant, PGE2, inhibe la croissance tumorale
[41]. Les effets de PGE2 sont gérés par quatre types de
récepteurs : EP1, EP2, EP3 et EP4.
• Sous-types et isoformes des re´ cepteurs
du PGE2
Structure moléculaire
La PGE2 possède quatre récepteurs isotypes (EP1 à
EP4), de sept segments transmembranaires, couplés
aux protéines Gαi, GαsouGαq. Le récepteur EP4 pos-
sède une longue extrémité, intracellulaire, C-terminale
et une troisième boucle large comme pour le récepteur
EP1, tandis que les récepteurs EP3 et EP4 ont une struc-
ture plus compacte. Le récepteur EP3 est exprimé en
trois variants générés par l’épissage alternatif au
niveau de la queue C-terminale ; par exemple, la souris
exprime les iso-formes EP3α, EP3βet EP3γqui ont en
commun le même ligand ; en revanche, la fixation de
ce ligand sur ces récepteurs transduit différentes voies
de signalisation. Les quatre isotypes (EP1 à EP4) répon-
dent tous au PGE2, mais ils présentent une différence
au niveau des acides aminés, par exemple : EP1 mon-
tre une homologie respective par rapport à EP2, EP3 et
EP4 de 30, 33 et 28 %. Pourtant, alors que la stimula-
tion des récepteurs EP2 et EP4 est couplée à l’activation
de l’adénylate-cyclase, ces deux récepteurs montrent
seulement une homologie de 31 % [42].
Transduction du signal
L’approche d’étude basée sur l’utilisation des agonis-
tes, des récepteurs EP1 à EP4 et leurs effets dans l’in-
duction des messagers secondaires tels que Ca
2+
et
cAMP a montré que l’activation du récepteur EP1, par
PGE2, induit une élévation de concentration de la
forme libre de Ca
2+
intracellulaire, tandis que les
récepteurs EP2 et EP4 sont couplés à la protéine Gs et
augmentent la concentration de l’AMPc intracellulaire.
Cependant, le récepteur EP3 est couplé à la protéine
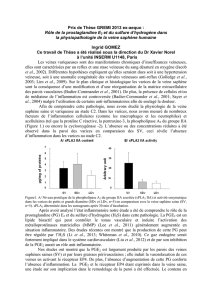
Gi et diminue la concentration de l’AMPc (figure 1).
•Re´ gulation d’expression
La régulation d’expression du gène des récepteurs EP
varie en fonction du contexte physiologique ou physio-
pathologique. L’analyse du promoteur des gènes EP2
et EP4 a montré la présence de plusieurs éléments de
réponse impliqués dans la réponse inflammatoire tels
que NF-IL6, NF-κB et AP2. Également, le promoteur
du gène EP2 contient des régions de réponse à la pro-
gestérone [43] ; de plus, plusieurs sites ont été trouvés
au niveau du promoteur du gène EP4 tels que AP1,
AP2, Sp1, NF-κB, MyoD, NF-IL6 et l’élément de
réponse du glucocorticoïde. L’analyse fonctionnelle a
permis de montrer la présence d’une séquence consen-
sus de réponse pour LPS/Serum entre –554 et –116 pb
[44].
• Tumorogene` se colique et PGE2 :
les voies de signalisation induites par le PGE2
Des expériences d’invalidation des gènes (Knockout),
codants pour ces récepteurs, ont permis de mettre en
évidence les sous-types impliqués dans la cancéroge-
nèse colique. Contrairement au récepteur EP3, le
récepteur EP1 est impliqué dans la cancérogenèse
colique chez la souris [45]. Une délétion du récepteur
EP2 diminue le nombre et la taille des polypes chez la
souris APC
Δ716
[46]. L’invalidation du gène codant
EP4 montre que ce récepteur est indispensable à la for-
mation de cryptes aberrantes induites par l’AOM. L’im-
plication d’EP4 dans les étapes précoces de la cancé-
rogenèse colique est confirmée par l’ONO-AE2-227,
un antagoniste spécifique du récepteur EP4, qui dimi-
nue le nombre de polypes chez la souris APC
min
.À
l’inverse, PGE2 et l’agoniste de EP4 (ONOAE1-329)
augmentent le nombre de colonies capables de prolifé-
rer en milieu semi-solide (agar mou), reflétant la capa-
cité de croissance indépendante de l’ancrage, un
mécanisme associé à la progression tumorale [25].
140 He
´pato-Gastro, vol. 16, n°2, mars-avril 2009
Mini-revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

La stimulation de la lignée de carcinome colorectal
humain LS174T, par la PGE2, induit l’augmentation de
la motilité cellulaire et entraîne un changement de mor-
phologie du tapis cellulaire caractérisé par la formation
de protubérances et de fibres de stress. L’effet est trans-
mis par le récepteur EP4 qui active la voie PI3-K/Akt,
suggérant que la PGE2, inhibant la mort cellulaire pro-
grammée et induisant Bcl2, favorise le potentiel invasif
des cellules de carcinomes coliques [47, 48].
Le niveau basal d’expression de PGE2 dépend du rap-
port Cox2/15-PGDH (15-PG déshydrogénase). Cox2
en assure la synthèse, tandis que le 15-PGDH le
dégrade. Le 15-PGDH est fortement exprimé dans le
tissu colique normale, mais cette expression fait défaut
au niveau du tissu tumoral intestinal [49]. Le traitement
avec la PGE2 augmente considérablement le nombre
de polypes intestinaux chez la souris APC
min
et signifi-
cativement la carcinogenèse colique induite par l’agent
carcinogène AOM [50]. De plus, l’induction de la pro-
duction excessive de PGE2, par l’inhibition de sa
dégradation en délétant le gène 15-PGDH chez la sou-
ris APC
min
et le modèle AOM (carcinogenèse induite
par l’AOM), accélère les processus de la croissance
tumorale [51]. D’une façon similaire, l’augmentation
de la production de PGE2 endogène par l’hyperexpres-
sion de Cox2 et le microsomal prostaglandin E
synthase-1 est suffisante pour induire la formation de
tumeur gastrique [52]. La PGE2 est capable de restau-
rer la diminution de la charge tumorale, induite par le
traitement avec les AINS, chez la souris APC
min
[53].
L’interaction de la PGE2 et ses récepteurs EP déclenche
un mécanisme moléculaire très complexe, dont on
Ca2+
cAMP cAMP cAMP
Glycerophospholipide
PLA2
Acide arachidonique
ANIS Coxibs
COX1
COX2
PGG2 PGH2
TXA2
PGD2
PGF2α
PG12
PG
synthase
AC
ATP
Ras
GEF
Ras
Raf
PKC
DAG
PLCβ
Gq
GTP
EP1 EP2 EP3 EP4
Gαs
GTP Gγ
Gγ
Gβ
Gβ
GβGβ
GγGγ
Gαs
GTP
Gαs
GTP
AC AC
PGE2
Figure 1. Présentation schématique du métabolisme de l’acide arachidonique dont l’un des produits, la prostaglandine E2 (PGE2), active
quatre types de récepteurs à sept segments transmembranaires (EP1, EP2, EP3, EP4). Cox : cyclo-oxygénase ; AINS : anti-inflammatoire
non stéroïdien ; PG : prostaglandine ; EP : récepteur du PGE2 ; PLA2 : phospholipase A2 ; TX : thromboxane ; ATP: adénosine triphos-
phate ; cAMP: adénosine monophosphate cyclique.
141
He
´pato-Gastro, vol. 16, n°2, mars-avril 2009
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%