Douleurs neuropathiques liées aux traitements du cancer du sein

MISE AU POINT
30
La Lettre du Sénologue - n° 26 - octobre/novembre/décembre 2004
iège du cancer le plus fréquent chez la femme, le
sein possède une innervation propre et se situe à
proximité du plexus brachial. Il est donc facile
d’imaginer la multiplicité des lésions potentielles du système
nerveux périphérique au cours de la prise en charge du cancer
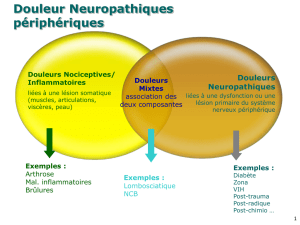
du sein. Ces lésions font le lit des douleurs neuropathiques (1)
qui sont fréquentes (40% des patients cancéreux douloureux
[2]), sévères et difficiles à traiter. Elles possèdent des carac-
tères cliniques communs :
– douleur permanente à type de brûlure ou de compression,
avec une composante paroxystique, fulgurante, à type de
décharge électrique, de coup d’éclair ou d’aiguille ;
– dysesthésies revêtant un caractère désagréable ;
– douleurs provoquées : allodynie (douleur pour un stimulus
habituellement non douloureux) et hyperalgésie (réponse exa-
gérée à un stimulus douloureux) ;
– déficit sensitif systématisé en rapport avec la chirurgie.
Le tableau clinique varie cependant en fonction de la structure
nerveuse atteinte (tableau I) : ce travail se propose d’exposer les
différents types de douleurs neuropathiques liées aux traitements
du cancer du sein et l’état actuel de leur prise en charge. Les
moyens de prévention, s’ils existent, doivent évidemment être
privilégiés dans ce contexte de iatrogénicité ; la douleur neuropa-
thique, permanente et chronique, devient en effet rapidement plu-
rifactorielle.
DOULEURS NEUROPATHIQUES ET CHIRURGIE
La chirurgie est la première cause de développement de dou-
leurs neuropathiques, du fait de la nécessité d’un geste satisfai-
sant sur le plan carcinologique. Quatre grands tableaux cli-
niques se distinguent dans le cadre de la chirurgie du cancer du
sein, comme en témoigne la classification proposée par Jung
(3). Si l’apparition de certains tableaux reste imprévisible,
l’accent doit toujours être mis sur la prévention des lésions évi-
tables et sur la qualité de l’analgésie périopératoire (4).
Douleur neuropathique intercostobrachiale
Le nerf intercostobrachial est issu d’une branche perforante
latérale du deuxième nerf intercostal ; il chemine à l’intérieur
du tissu adipeux de l’aisselle pour rejoindre le nerf cutané
médial du bras, lui-même issu du plexus brachial (5-7). Ce nerf
sensitif peut être lésé par un simple étirement peropératoire ;
c’est cependant durant le curage ganglionnaire axillaire qu’il
est le plus exposé et très souvent sectionné. La patiente est
alors exposée au développement de douleurs neuropathiques
non seulement axillaires, mais également thoraciques et bra-
chiales hautes du fait des anastomoses décrites plus haut (8, 9).
Ce tableau, appelé “syndrome douloureux postmammectomie”
par les Anglo-Saxons, a longtemps été sous-estimé (9-11). Sa
Traitement en cause Type de douleur Lésion du système nerveux
Chirurgie douleur neuropathique nerf intercostobrachial
intercostobrachiale
Chirurgie douleur cicatricielle rameaux cutanés
des nerfs intercostaux
– section
– névrome
Chirurgie algohallucinose sections nerveuses
remaniements corticaux
Chirurgie autres lésions nerveuses nerf intercostaux
plexus brachial
nerf médian
Chimiothérapie polyneuropathies toxiques fibres sensitives distales
Radiothérapie plexopathie brachiale fibrose plexus brachial
postradique
Tableau I.
Classification des douleurs neuropathiques liées aux traite-
ments du cancer du sein.
Douleurs neuropathiques liées aux traitements du cancer
du sein : classification et prise en charge
Breast cancer-related neuropathic pain: classification and management
●
F. Clère*
* Consultation d’évaluation et de traitement de la douleur, clinique Sainte-
Marie, L'Isle d'Espagnac.
SS
La difficulté de prise en charge de la douleur cancéreuse est
principalement liée à deux entités cliniques : les pics doulou-
reux et les douleurs neuropathiques. Ces dernières, liées à une
lésion du système nerveux, sont multiples après traitement étio-
logique du cancer du sein, mais relativement mal connues et
sous-estimées. Quels sont les tableaux cliniques rencontrés ?
Est-il possible de les prévenir ? Comment les prendre en
charge ? C’est à ces questions que ce travail se propose de
répondre, en se fondant sur les données de la littérature.

31
La Lettre du Sénologue - n° 26 - octobre/novembre/décembre 2004
prévalence est pourtant proche des 40% (12, 13) lorsque le
nerf intercostobrachial est sacrifié, avec un retentissement
potentiellement sévère en termes de vie quotidienne (9). La
prévention est donc de mise, d’autant qu’elle reste le plus sou-
vent possible, en l’absence d’envahissement tumoral axillaire.
La préservation du nerf intercostobrachial n’allonge pas signi-
ficativement la durée du geste chirurgical, qui reste complet
sur le plan carcinologique (5, 6, 13, 14). Par ailleurs, la biopsie
du ganglion sentinelle doit permettre de limiter le nombre de
curages ganglionnaires agressifs (8, 13). Tableau clinique
méconnu, la douleur neuropathique intercostobrachiale mérite
donc bien une attention particulière.
Douleur cicatricielle
L’innervation sensitive du sein est assurée par les 4e, 5eet 6e
nerfs intercostaux, qui cheminent le long du fascia pectoral
latéral avant de pénétrer dans le parenchyme glandulaire mam-
maire (15). La section chirurgicale des filets nerveux cutanés
est donc obligatoire en cas de mammectomie, et responsable
de douleurs neuropathiques chez 31% des patientes à 6 ans du
geste chirurgical, présentes dès la 3esemaine (16, 17). La zone
cicatricielle peut également être le siège de névromes, parfois
non détectables cliniquement, mais qui contribuent à l’hyper-
excitabilité de la corne dorsale de la moelle (3).
Douleur du sein fantôme
Le perception persistante du sein opéré constitue l’hallucinose. Si
ce sein est douloureux, il faut parler d’algohallucinose (18). Ce
phénomène de sein fantôme douloureux touche 13 à 17% des
patientes opérées (16) sans diminution de l’incidence à 6 ans (17).
Il est donc moins fréquent qu’en cas d’amputation d’un membre,
probablement du fait d’une représentation sensorielle corticale
restreinte et de l’absence d’informations d’ordre kinesthésique
transmises aux structures cérébrales (17, 18). Ainsi, la symptoma-
tologie douloureuse concerne l’ensemble du sein et ne témoigne
pas de phénomènes de télescopage (18). Il semble également que
le développement de l’algohallucinose soit lié à l’existence de
douleurs préopératoires, puis favorisé par l’existence de douleurs
cicatricielles (16, 17). La qualité de l’analgésie périopératoire pré-
sente donc un intérêt majeur.
Douleur liée aux autres lésions nerveuses
Du fait des caractéristiques anatomiques décrites plus haut, les
nerfs intercostaux peuvent faire l’objet de lésions bien en
amont de la zone cicatricielle ; la douleur concerne alors le
dermatome en rapport avec une distribution en hémiceinture.
Une douleur localisée avec signe de Tinel est en faveur d’un
névrome, qui peut être infiltré, voire réséqué (15).
La proximité de la zone axillaire, la lésion fréquente pendant le
curage ganglionnaire des nerfs intercostobrachial et cutané
médial du bras, ainsi qu’un étirement peropératoire peuvent être
à l’origine d’une atteinte du plexus brachial (10, 15). La douleur
est alors prépondérante dans les territoires radiculaires les plus
atteints en neurophysiologie. L’évolution peut être marquée par
un véritable syndrome douloureux régional complexe de type II,
avec phénomènes vasomoteurs associés, syndrome épaule-main
et/ou capsulite rétractile de l’épaule (1, 19).
Le lymphœdème postchirurgical peut être à l’origine d’un véri-
table syndrome secondaire du canal carpien unilatéral, avec
douleurs séquellaires dans le territoire du nerf médian (19).
La littérature (3, 10, 15) rapporte des douleurs liées à l’atteinte
des nerfs pectoraux, long thoracique et thoracodorsal ; s’agis-
sant de nerfs moteurs, il est plus vraisemblable que la douleur
soit alors d’origine musculo-squelettique (15).
DOULEURS NEUROPATHIQUES ET CHIMIOTHÉRAPIE
Les mononeuropathies par extravasation de produit étant deve-
nues anecdotiques depuis l’utilisation des chambres implantables,
la toxicité neurologique des molécules de chimiothérapie
s’exprime sous la forme de polyneuropathies sensitives (20-22).
Les anthracyclines, molécules de référence dans le cancer du sein,
ne sont pas neurotoxiques ; leur principal effet secondaire est une
cardiotoxicité dose-dépendante. En revanche, le cyclophospha-
mide et le 5-fluoro-uracile, associés aux anthracyclines dans les
protocoles FEC, ont été incriminés. Les trois principales familles
neurotoxiques sont les vinca-alcaloïdes, les sels de platine et les
taxanes : cette dernière classe peut également être utilisée en cas
de cancer du sein métastatique. La neurotoxicité est alors aiguë
dès la première cure, touchant les grosses fibres sensitives, et
habituellement réversible en quelques mois. Les polyneuropathies
douloureuses liées au traitement du cancer du sein restent donc
peu fréquentes.
DOULEURS NEUROPATHIQUES ET RADIOTHÉRAPIE
La myélopathie postradique reste rare dans le cancer du sein ;
l’atteinte nerveuse concerne ici presque exclusivement le plexus
brachial, surtout en cas d’irradiation du creux axillaire. La plexopa-
thie ischémique aiguë par lésion vasculaire de l’artère subclavière
est également rare, retardée et accessible à la désobstruction (23).
Une plexopathie transitoire a été décrite à quatre mois de radiothé-
rapie chez 1,5% des patientes : son origine est inconnue. Si elle est
douloureuse dans 40% des cas, elle est également rapidement
réversible (24). La problématique principale est donc bel et bien la
plexopathie par fibrose postradique (22, 25, 26) après irradiation
des structures axillaires et subclavières. Son apparition peut être
très retardée, jusqu’à 20 ans après traitement, justifiant alors d’éli-
miner une récidive locorégionale. La symptomatologie doulou-
reuse, présente dans 20% des cas, concerne surtout le territoire
plexique supérieur (C5 et C6). Des mesures préventives de protec-
tion sont donc toujours nécessaires, malgré un meilleur fractionne-
ment de la radiothérapie.

MISE AU POINT
32
PRINCIPES DE PRISE EN CHARGE
Les douleurs neuropathiques liées aux traitements du cancer
du sein ont fait l’objet de peu d’études contrôlées de bonne
qualité méthodologique ; il n’existe donc pas de données suffi-
santes pour établir des recommandations d’Evidence-Based
Medicine (3). Les traitements classiques des douleurs neuropa-
thiques sont utilisés par analogie en oncologie (tableau II), ce
qui semble adapté à la pratique clinique (3). Dans tous les cas,
il convient d’adapter la prise en charge au patient, aux béné-
fices/risques attendus et aux caractéristiques de la douleur.
Les moyens
Les antidépresseurs tricycliques (action sur le fond douloureux
permanent) et les antiépileptiques (action sur les paroxysmes)
restent les molécules de première intention (27-30). Trois
d’entre elles ont obtenu une AMM spécifique :
– la clomipramine (Anafranil®) : douleurs neuropathiques ;
– l’amitriptyline (Laroxyl®) : douleurs chroniques rebelles ;
– la gabapentine (Neurontin®) : douleurs postzoostériennes.
Les topiques locaux (31) constituent une aide complémentaire
précieuse si la surface cutanée douloureuse reste réduite,
notamment en cas de mauvaise tolérance médicamenteuse ou
d’allodynie importante gênant le port de vêtements. La lidocaïne
et la capsaïcine sont les deux molécules les plus intéressantes,
disponibles en France en autorisation temporaire d’utilisation
(ATU), respectivement sous forme de patch à conserver 12 heures
(Neurodol®) et de crème à appliquer 3 à 4 fois par jour (Zostrix®).
Les antagonistes des récepteurs NMDA, dont la kétamine (32), et
les antiarythmiques (28, 30) sont proposés en seconde intention
en cas de douleur et d’allodynie rebelles.
La neurostimulation transcutanée (NSTC) est une technique
simple et efficace en cas de douleur mono- ou biradiculaire, qui
nécessite une prescription de la part d’une structure d’évaluation
et de traitement de la douleur (33, 34). La neurochirurgie fonc-
tionnelle peut être proposée à des patients sélectionnés (34), soit
à type d’interruption des voies nociceptives (DREZotomie, cor-
dotomie, tractotomie mésencéphalique), soit à type de neuromo-
dulation (stimulation médullaire ou corticale).
Ces techniques sophistiquées ne sont bien entendu envisagées
qu’au décours d’une prise en charge globale (33), notamment sur
le plan psychologique, indispensable dans le contexte de la can-
cérologie. La relaxation, voire l’hypnose sont des thérapies com-
plémentaires utilisables en parallèle du nécessaire soutien psy-
chologique (valeur symbolique forte du sein chez la femme).
La pratique
Il convient avant tout de rappeler l’intérêt primordial de la préven-
tion des douleurs neuropathiques, permanentes et définitives, qui
viennent rapidement majorer la souffrance morale de ces
patientes. Cette prévention concerne aussi bien le geste chirurgical
que l’anesthésie périopératoire ou les traitements adjuvants.
Les douleurs neuropathiques intercostobrachiales sont les
seules à avoir fait l’objet de trois études contrôlées. À visée
préventive, la venlafaxine (Effexor®) a fait la preuve de son
efficacité dans la période périopératoire (35), avec une réduc-
tion significative de l’incidence de la douleur (20%) par rap-
port au groupe placebo (> 40%). Cette molécule semble pro-
metteuse puisqu’elle est également efficace en phase de
douleur installée (36), à la dose de 75 mg par jour. Son action
sur le métabolisme de la noradrénaline et de la sérotonine la
rapproche des antidépresseurs tricycliques, eux-mêmes effi-
caces dans l’étude de Kalso (37) à la dose quotidienne de 50 mg,
sans leurs effets délétères anticholinergiques. Watson a pu
confirmer l’efficacité de la capsaïcine dans une petite série de
patientes, à condition de bien prendre en charge la classique
brûlure locale du début de traitement (38). La lidocaïne en
patch mais aussi la NSTC trouvent ici tout leur intérêt.
Les douleurs cicatricielles sont l’indication privilégiée des
traitements non médicamenteux (topiques locaux, NSTC). La
résection chirurgicale d’un névrome peut se révéler nécessaire
(3, 15).
À l’opposé, la prise en charge de l’algohallucinose fait appel
aux moyens médicamenteux, voire à la neurochirurgie : la sti-
mulation corticale est alors la plus pertinente du fait de la
démyélinisation majeure et des phénomènes de remaniements
corticaux (16-18). Par ailleurs, une analgésie préopératoire
maximale doit permettre de réduire significativement son inci-
dence (18).
Les douleurs plexulaires, postchirurgicales ou postradiques,
sont également une bonne indication des traitements médica-
menteux, mais aussi de la NSTC si la douleur reste pauciradi-
culaire. La DREZotomie peut se révéler nécessaire en cas de
paroxysmes douloureux sévères non contrôlés médicalement,
tout comme la stimulation corticale en cas de fond permanent
de territoire étendu.
Pour ce qui est des polyneuropathies douloureuses installées,
peu fréquentes mais potentiellement invalidantes, les antidé-
presseurs et les antiépileptiques restent efficaces.
La Lettre du Sénologue - n° 26 - octobre/novembre/décembre 2004
Type de traitement Molécule ou technique
Médicamenteux antidépresseurs tricycliques :
– clomipramine (Anafranil®)
– amitriptyline (Laroxyl®)
antidépresseurs IRSN :
– venlafaxine (Effexor®)
antiépileptiques :
– gabapentine (Neurontin®)
2eintention : kétamine, antiarythmiques
Topiques locaux lidocaïne patch (Lidoderm®)
capsaïcine crème (Zostrix®)
Neuromodulation NSTC
stimulation médullaire
stimulation corticale
Neurochirurgie d’interruption DREZotomie
Tableau II. Principes de prise en charge des douleurs neuropathiques
liées aux traitements du cancer du sein.

33
La Lettre du Sénologue - n° 26 - octobre/novembre/décembre 2004
CONCLUSION
Les trois piliers du traitement du cancer du sein, la chirurgie, la
radiothérapie et la chimiothérapie, sont, par ordre de fréquence
décroissant, à l’origine de douleurs neuropathiques iatrogènes.
Leur fréquence, leur sévérité potentielle et leur réponse par-
tielle aux traitements spécifiques doivent faire promouvoir les
moyens de prévention, lorsqu’ils existent, en chirurgie et en
anesthésie. Une fois le tableau douloureux installé, il devient
vite permanent, chronique, multifactoriel. Aucun doute ne doit
persister quant à l’éventualité d’une récidive tumorale, tant
chez le thérapeute que chez la patiente, fragilisée par les
conséquences de la pathologie cancéreuse. Une prise en charge
globale s’impose alors, sur un mode bio-psychosocial, afin
d’optimiser l’utilisation et l’association des traitements médi-
camenteux, locaux ou neurochirurgicaux.
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1.
Merskey H, Bogduk N. Classification of chronic pain: descriptions of chronic
pain syndromes and definitions of pain terms. Second edition. Seattle: IASP
Press,1994:209-14.
2.
Caraceni A, Portenoy R, a working group of the IASP Task Force on Cancer
Pain. An international survey of cancer pain characteristics and syndromes.
Pain 1999;82:263-74.
3.
Jung BF, Ahrendt GM, Oaklander AL, Dworkin RH. Neuropathic pain follo-
wing breast cancer surgery: proposed classification and research update. Pain
2003;104:1-13.
4.
Viel E, Eledjam JJ. Les douleurs chroniques postchirurgicales. Un problème
de santé publique? Le Courrier de l’Algologie 2004;3:45-50.
5.
Torresan RZ, Cabello C, Conde DM, Brenelli HB. Impact of the preservation
of the intercostobrachial nerve in axillary lymphadenectomy due to breast can-
cer. Breast J 2003;9:389-92.
6.
Paredes JP, Puente JL, Potel J. Variations in sensitivity after sectioning the
intercostobrachial nerve. Am J Surg 1990;160:525-8.
7.
Temple WJ, Ketcham AS. Preservation of the intercostobrachial nerve during
axillary dissection for breast cancer. Am J Surg 1985;150:585-8.
8.
Miguel R, Kuhn AM, Shons AR et al. The effect of sentinel node selective axil-
lary lymphadenectomy on the incidence of postmastectomy pain syndrome. Can-
cer Control 2001;8:427-30.
9.
Stevens PE, Dibble SL, Miaskoxski C. Prevalence, characteristics, and impact
of postmastectomy pain syndrome: an investigation of women’s experiences.
Pain 1995;61:61-8.
10.
Wallace MS, Wallace AM, Lee J, Dobke MK. Pain after breast surgery: a
survey of 282 women. Pain 1996;66:195-205.
11.
Vecht CJ, Van de Brand HJ, Wajer OJ. Post-axillary dissection pain in
breast cancer due to a lesion of the intercostobrachial nerve. Pain 1989;38:171-
6.
12.
Smith WCS, Bourne D, Squair J et al. A retrospective cohort study of post
mastectomy pain syndrome. Pain 1999;83:91-5.
13.
Taylor KO. Morbidity associated with axillary surgery for breast cancer.
ANZ J Surg 2004;74:314-7.
14.
Abdullah TI, Iddon J, Barr L et al. Prospective randomized controlled trial
of preservation of the intercostobrachial nerve during axillary node clearance
for breast cancer. Br J Surg 1998;85:1443-5.
15.
Wong L. Intercostal neuromas: a treatable cause of postoperative breast
surgery pain. Ann Plast Surg 2001;46:481-4.
16.
Kroner K. Krebs B, Skov J, Jorgensen HS. Immediate and long-term phan-
tom breast syndrome after mastectomy: incidence, clinical characteristics and
relationship to pre-mastectomy breast pain. Pain 1989;36:327-34.
17.
Kroner K, Knudsen UB, Lundby L, Hvid H. Long-term phantom breast syn-
drome after mastectomy. Clin J Pain 1992;8:346-50.
18.
Jensen TS, Nikolajsen L. Phantom pain and other phenomena after amputa-
tion. In: Wall PD, Melzack R (ed). Textbook of pain, fourth edition. Édimbourg:
Churchill Livingstone, 1999:799-814.
19.
Vecht CJ. Arm pain in the patient with breast cancer. J Pain Symptom
Manage 1990;5:109-17.
20.
Lebrun C, Frenay M. Neurotoxicité des chimiothérapies chez l’adulte. Rev
Neurol 2003;159:741-54.
21.
Lebrun C, Frenay M, Lantéri-Minet M. Complications neurologiques de la
chimiothérapie. Rev Med Interne 1999;20:902-11.
22.
Uhm JH, Yung WK. Neurologic complications of cancer therapy. Curr Treat
Options Neurol 1999;1:428-37.
23.
Gerard JM, Franck N, Moussa Z, Hildebrandt J. Acute ischemic brachial
plexus neuropathy following radiation therapy. Neurology 1989;39:450-1.
24.
Salner AL, Botnick LE, Herzog AG et al. Reversible brachial plexopathy fol-
lowing radiation therapy for breast cancer. Cancer Treat Rep 1981;65:797-802.
25.
Portenoy RK. Cancer pain: pathophysiology and syndromes. Lancet
1992;339:1026-31.
26.
Krakowski I, Conroy T, Bey P. Place des traitements anticancéreux dans la
prise en charge de la douleur cancéreuse: chirurgie, radiothérapie et traite-
ments médicaux spécifiques. In: Brasseur L, Chauvin M, Guilbaud G (ed). Dou-
leurs, bases fondamentales, pharmacologie, douleurs aiguës, douleurs chro-
niques, thérapeutiques. Paris: Maloine, 1997:597-626.
27.
Sindrup SH, Jensen TS. Antidepressants in the treatment of neuropathic
pain. In: Hansson PT, Fields HL, Hill RG, Marchettini P (ed). Neuropathic
pain: pathophysiology and treatment. Seattle: IASP Press, 2001:169-83.
28.
Backonja M. Anticonvulsivants and antiarythmics in the treatment of neuro-
pathic pain syndromes. In: Hansson PT, Fields HL, Hill RG, Marchettini P (ed).
Neuropathic pain: pathophysiology and treatment. Seattle: IASP Press,
2001:185-201.
29.
Farrar JT, Portenoy RK. Neuropathic cancer pain: the role of adjuvant
analgesics. Oncology 2001;15:1435-42.
30.
Cavenagh J, Burstal R. Adjunct therapies, e.g. antidepressants. In: Sykes N,
Fallon MT, Patt RB (ed). Clinical Pain Management. Cancer Pain. Londres:
Arnold, 2003:209-34.
31.
Watson CPN. Topical local anesthesics for neuropathic pain. In: Hansson
PT, Fields HL, Hill RG, Marchettini P (ed). Neuropathic pain: pathophysiology
and treatment. Seattle: IASP Press, 2001:215-21.
32.
Mercadante S. Ketamine in cancer pain: an update. Palliat Med 1996;
10:225-30.
33.
Filshie J. The non-drug treatment of neuralgic and neuropathic pain of mali-
gnancy. Cancer Surv 1988;7:161-93.
34.
Stannard C. Stimulation-induced analgesia in cancer pain management. In:
Sykes N, Fallon MT, Patt RB (ed). Clinical Pain Management. Cancer Pain.
Londres: Arnold, 2003:245-51.
35.
Reuben SS, Makari-Judson G, Lurie SD. Evaluation of efficacy of the perio-
perative administration of venlafaxine XR in the prevention of postmastectomy
pain syndrome. J Pain Symptom Manage 2004;27:133-9.
36.
Tasmuth T, Hartel B, Kalso E. Venlafaxine in neuropathic pain following
treatment of breast cancer. Eur J Pain 2002;6:17-24.
37.
Kalso E, Tasmuth T, Neuvonen P. Amitriptyline effectively relieves neuropa-
thic pain following treatment of breast cancer. Pain 1995;64:293-302.
38.
Watson CP, Evans RJ, Watt VR. The post-mastectomy pain syndrome and
the effect of topical capsaicin. Pain 1989;38:177-86.
1
/
4
100%

![21.Francis PONGE : Le parti pris de choses [1942]](http://s1.studylibfr.com/store/data/005392976_1-266375d5008a3ea35cda53eb933fb5ea-300x300.png)