Physique quanti..

Dr A. Sicard CapeSup Grenoble Page 1
Cours n°16 : Physique quantique
1) Nature corpusculaire de la lumière
La lumière peut être vue sous deux aspects : ondulatoire et corpusculaire. Dans ce chapitre nous
allons étudier l’aspect corpusculaire.
La lumière peut donc être décrite comme une onde de fréquence , qui se propage comme un
ensemble de corpuscules de masse nulle en mouvement appelés photons.
Un photon porte le quantum d’énergie tel que :
s’exprime en , en .
est la constante de Planck de valeur .
De plus
avec la célérité de la lumière dans le vide et en la longueur d’onde de la
radiation.
Formule pratique
Un photon va donc transporter une énergie correspondant à sa fréquence.
2) Comportement quantique de l’atome
2.1) Quantification des états d’énergie
2.1.1) Principe de base de la physique quantique
L’atome ne peut exister que dans certains états d’énergie bien définis. Ces états sont caractérisés par
un niveau d’énergie correspondant aux orbites sur lesquelles peuvent graviter des électrons. Ces
orbites sont quantifiées.
L’énergie d’un atome ne peut prendre que certaines valeurs discrètes appelées niveaux d’énergie de
l’atome et notées
Par définition, on appelle état fondamental, l’état d’énergie correspondant au niveau d’énergie le
plus bas que peut prendre l’atome. C’est un état stable. Les autres états d’énergie sont appelés états
excités et sont instables.

Dr A. Sicard CapeSup Grenoble Page 2
Lorsqu’un atome est excité, l’énergie de l’ensemble de l’atome augmente. Si l’énergie reçue par
l’atome est suffisante, il est possible d’arracher un électron au cortège électronique. L’atome est
alors ionisé.
Par définition, on appelle énergie de première ionisation d’un atome, l’énergie à fournir à un atome
initialement dans son état fondamental pour lui arracher un électron.
Convention de signe pour les niveaux d’énergie
Par convention, l’énergie de l’atome ionisé est considérée comme nulle . Les états
d’énergie de l’atome sont négatifs .
2.1.2) Niveaux d’énergie de l’atome d’hydrogène
L’énergie de l’atome d’hydrogène ne peut avoir que des valeurs discrètes. Lorsqu’un électron décrit
une orbite de rayon , il occupe le niveau d’énergie correspondant . On a pour l’hydrogène :
où est le rayon de Bohr de valeur .
Les niveaux d’énergie de l’atome d’hydrogène sont donnés par la relation suivante uniquement
valable et utilisable pour l’atome d’hydrogène :
Energie de première ionisation .
Les niveaux d’énergie forment une suite discontinue d’états possibles pour l’atome représentés par
une série de traits horizontaux
états excités
état fondamental

Dr A. Sicard CapeSup Grenoble Page 3
2.2 Echanges d’énergie
Un atome peut échanger de l’énergie avec l’extérieur sous forme de rayonnement, par
bombardement électronique, par décharge électrique…
Ces échanges d’énergie ne peuvent prendre que certaines valeurs particulières. Un atome transitant
d’un niveau d’énergie à un niveau d’énergie échange une quantité d’énergie qui correspond à
la variation d’énergie au cours de la transition. La quantification des états d’énergie entraine une
quantification de l’échange d’énergie. Les échanges d’énergie se font ainsi par quanta d’énergie.
2.2.1) Désexcitation
La désexcitation ou transition d’un niveau d’énergie vers un niveau d’énergie inférieur
d’accompagne de l’émission du quantum d’énergie :
Ce quantum d’énergie est émis sous la forme d’un photon d’énergie , soit de longueur
d’onde :
et de fréquence
photon d’énergie
atome excité
à l’état
atome à l’état
après émission
d’un photon
photon

Dr A. Sicard CapeSup Grenoble Page 4
2.2.2) Excitation
L’excitation ou transition d’un niveau d’énergie vers un niveau d’énergie supérieur
d’accompagne de l’absorption du quantum d’énergie :
Ce quantum d’énergie peut être absorbé sous deux formes :
- Interaction avec un photon d’énergie
Les seuls photons pouvant interagir avec l’atome ont une énergie correspondant à la transition entre
deux niveaux énergétiques de l’atome. Ils auront une longueur d’onde . L’atome passera après
absorption d’un photon à l’état d’énergie .
Si un photon se présente avec une énergie différente de celle de la transition, il n’interagira pas.
- Interaction avec un électron
Par collision, un électron d’énergie cinétique suffisante pourra céder une partie de son énergie et
exciter l’atome vers un état d’énergie . Il sera alors diffusé en emportant l’énergie cinétique
restante
photon
d’énergie
photon

Dr A. Sicard CapeSup Grenoble Page 5
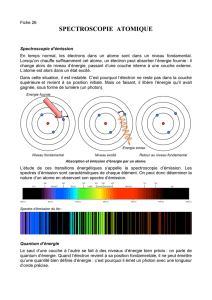
3) Spectroscopie
3.1) Spectre d’énergie
Il est possible en étudiant la lumière émise ou absorbée par un corps, de connaître la composition de
ce corps. C’est la technique dite de spectroscopie.
Par décomposition spectrale de cette lumière, il est possible de mettre en évidence les différentes
raies caractéristiques de l’élément composant le corps étudié. Ces différentes raies prouvent
expérimentalement la quantification des états d’énergie et donc celle des niveaux d’énergie eux-
mêmes.
L’ensemble des radiations que peut émettre ou absorber un atome constitue son spectre. Chaque
type d’atome possède un spectre qui permet de l’identifier.
Le spectre d’un atome constitue sa « carte d’identité ».
Il existe deux types de spectres : les spectres d’émission et les spectres d’absorption.
3.2 Spectre d’émission
Un gaz chauffé va émettre une radiation lumineuse complexe dont le spectre est discontinu. Seules
certaines longueurs d’onde sont présentes. On a le schéma suivant :
Le spectre d’émission comporte des raies colorées sur fond noir.
Lorsque le composé reçoit de l’énergie, ses atomes gagnent de l’énergie et passent d’un état stable à
un état excité. Les états excités étant instables, les atomes vont se désexciter et retourner vers leur
état fondamental en émettant un photon. Il n’y a pas de transition préférentielle, aussi toutes les
transitions sont présentes dans la lumière émise mais seules une partie d’entres elles seront dans le
domaine du visible ( ).
3.3) Spectre d’absorption
énergie apportée
(flamme, décharge
électrique)
source
lumineuse
prisme ou
réseau
spectre
d’émission
source lumineuse
substance prisme ou
réseau
spectre
d’absorption
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%