Mise en place des voies de la douleur chez le fœtus

Mise en place des voies de la douleur
chez le fœtus
Development of pain pathways in the human foetus
Annie Laquerrière
Laboratoire d’anatomie et de cytologie
pathologiques,
Pavillon Jacques-Delarue,
CHR, hôpital Charles-Nicolle,
1, rue de Germont, 76031 Rouen cedex,
France
Résumé. Au cours de la vie embryofœtale, les premières réponses aux stimuli nociceptifs se
traduisent par une contraction musculaire appelée réflexe spinal, précocement détectable,
puis évident et adapté après la 26
e
semaine d’aménorrhée (SA). La voie de la sensibilité
thermoalgique, médiée par la voie spinothalamique est en place après 20 SA et devient
fonctionnelle lorsqu’elle se connecte aux différentes aires corticales impliquées dans
l’intégration de la douleur, soit après 24 SA. C’est également à cette date que les relais
médullaires deviennent matures grâce à l’établissement des circuits neuromodulateurs
locaux. La dimension émotionnelle de l’expérience douloureuse serait fonctionnelle après
30 SA, date à laquelle apparaissent les états de vigilance, s’établissent les circuits de la
mémoire et les connections calleuses interhémisphériques. Il est admis par la plupart des
auteurs que la maturation fonctionnelle de l’ensemble de ces structures est nécessaire à la
perception consciente de la douleur dont l’apparition se situerait peu après le début de la
seconde moitié de la gestation.
Mots clés : douleur, nociception, foetus, développement
Abstract. During embryo-fetal life, early responses to noxious stimuli consist in muscle
contraction called spinal reflex, that is early detectable then obvious and appropriated
after the 26th week of amenorrhea (WA). The way of thermic pain sensitivity, mediated
through the spinothalamic way, is in place after 20 WA and becomes functional when it
connects to different cortical areas involved in the integration of pain, i.e., after 24 weeks.
It was at this time that the medullary relay become mature through the establishment
of local neuromodulator circuits. The emotional dimension of pain experience would be
functional after 30 weeks, when the vigilance states appear and when the memory circuits
and interhemispheric callosal connections take place. It is accepted by most authors that
the functional maturation of all these structures is necessary for conscious perception of
pain whose presence would fall just after the start of the second half of pregnancy.
Key words: pain, nociception, foetus, development
Définie par l’International Associa-
tion for the Study of Pain (IASP)
en 1979, la douleur est décrite comme
étant l’expression d’une expérience
sensorielle et émotionnelle désa-
gréable liée à une lésion tissulaire
existante, potentielle ou décrite en
termes d’une telle lésion [1-3].
Cette expérience consciente,
subjective et multidimensionnelle
sous-tendue par les apprentissages
antérieurs et les motivations actuelles,
implique la mise en jeu de mécanis-
mes complexes d’ordre physiopatho-
logique et psychologique à l’origine
de la sensation douloureuse [4]. Elle
résulte de quatre composantes :
–neurosensorielle : ensemble des
mécanismes nerveux permettant de
capter la durée, l’intensité et la
localisation du stimulus nociceptif.
Elle fait intervenir les mécanismes
neurophysiologiques de la nocicep-
tion incluant l’activation du thalamus
et du cortex pariétal ;
–affective et émotionnelle : tra-
duction comportementale résultant
de l’exaltation de la sensibilité affec-
tive telle que angoisse ou anxiété ;
–comportementale : correspondant
aux manifestations verbales et non
verbales du sujet qui souffre ;
–cognitive : qui donne à la dou-
leur sa signification et qui regroupe
doi: 10.1684/mte.2010.0285
mt Médecine de la Reproduction, Gynécologie Endocrinologie 2010 ; 12 (2) : 111-5
médecine thérapeutique
Médecine
de la Reproduction
Gynécologie
Endocrinolo
g
ie
Tirés à part : A. Laquerrière
mt Médecine de la Reproduction, Gynécologie Endocrinologie, vol. 12, n° 2, avril-mai-juin 2010
Congrès de médecine fœtale 2010, Morzine
111
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

des processus mentaux susceptibles d’influencer la per-
ception douloureuse (attention, interprétation, mémoire).
On décrit schématiquement deux types de douleur : la
douleur neuropathique qui résulte d’une lésion du
système nerveux central ou du système nerveux péri-
phérique et la douleur nociceptive qui provient de
dommages tissulaires autres que du tissu nerveux [3].
Sans intégration cognitive et psychologique du
contenu de la douleur, on parle de nociception :
ensemble des fonctions de l’organisme permettant de
détecter, de percevoir et de réagir à des stimuli potentiel-
lement nocifs. La nociception met en jeu l’activation
physique des voies nociceptives, sans intervention de
la composante subjective émotionnelle [1-3, 5]. Elle
engendre un réflexe de retrait sans perception consciente
de la douleur, alors que la composante psychologique
de la douleur présuppose la présence de circuits thala-
mocorticaux nécessaires à la perception consciente.
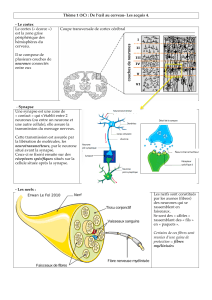
La nociception met en jeu des récepteurs périphériques
qui font synapse avec des interneurones dans la moelle
épinière, qui font eux-mêmes synapse avec les motoneu-
rones de la corne antérieure et dont la résultante est une
contraction musculaire [2, 5-7].
Sensibilité douloureuse chez l’adulte
Dans le système nerveux « mature », les voies de
la sensibilité s’organisent en deux systèmes aux fonctions
différentes : le système lemniscal, qui véhicule la sensi-
bilité tactile discriminative et la sensibilité articulaire, et
le système extralemniscal (voie spinothalamique) qui
véhicule la sensibilité à la douleur, au chaud, au froid
et la sensibilité tactile dite grossière. Ce dernier système
possède une double fonction : une fonction d’alarme
par ses projections sur la réticulée activatrice du tronc
cérébral et une fonction d’identification par ses projec-
tions corticales [5]. Ce système est composé de trois
neurones. Le signal nociceptif prend naissance à la
suite de l’activation de nocicepteurs qui sont les
terminaisons libres des fibres nerveuses : mécanonoci-
récepteurs activés par des stimuli intenses de nature
mécanique, et nocirécepteurs polymodaux qui répon-
dent à des stimuli mécaniques, thermiques et chimiques.
L’activation des nocirécepteurs est liée à la libération de
substances algogènes (histamine, sérotonine, bradykini-
nes, tachykinines dont la substance P, métabolites de
l’acide arachidonique, interleukines, endothélines, ATP,
protons, et nitric oxide). L’influx engendré est véhiculé
par les fibres A δpour les mécanonocirécepteurs et par
les fibres C non myélinisées pour les nocicepteurs, et se
propage aux corps cellulaires situés dans le ganglion
rachidien [3, 5, 8]. Ce premier neurone fait synapse
dans la moelle dorsale (lamina I et II). Le deuxième
neurone croise la ligne médiane et monte dans le cordon
antérolatéral (faisceau spinothalamique) jusqu’au niveau
du tronc cérébral. Certaines fibres vont s’articuler
sur la substance réticulée activatrice du tronc cérébral
(système d’éveil accompagnant la survenue d’une
sensation douloureuse). L’autre contingent projette sur
le thalamus et se connecte sur des neurones (troisième
neurone) d’où partent des efférences qui projettent
sur le cortex somatosensoriel et le cortex limbique.
Dans le cortex, l’information sera traitée de façon
cognitive [9].
Développement de la nociception
Maturation des circuits nociceptifs
Les terminaisons de la sensibilité périphérique appa-
raissent dès la huitième semaine de gestation, d’abord
dans la région péribuccale, s’étendant ensuite au visage
et à la paume des mains à partir de dix semaines,
l’ensemble des téguments étant couvert par ces terminai-
sons à 20 semaines. Ces récepteurs émettent des axones
qui se dirigent de façon spécifique sur les neurones du
ganglion rachidien, sous l’influence de molécules de
la matrice extracellulaire et en particulier, de la séma-
phorine 3A. Les axones fins non myélinisés expriment
le récepteur au nerve growth factor (NGF) très précoce-
ment. Le développement fonctionnel des récepteurs
nociceptifs est d’abord sous la dépendance du NGF,
puis plus tardivement du glial derived nerve factor
[6, 8, 11-14].
Au niveau du ganglion rachidien, plusieurs types
de neurones sont générés : des neurones de grande taille
qui recevront les afférences cutanées non nociceptives et
des neurones de petite taille exprimant le récepteur au
NGF (TrkA) qui recevront les fibres C nociceptives
non myélinisées. Lorsque les récepteurs ont acquis
leur maturation fonctionnelle, les neurones du ganglion
rachidien expriment alors des récepteurs qui reçoivent et
transmettent les informations nociceptives [8, 14].
Les connexions avec la substance grise médullaire
s’établissent entre la 13
e
et la 20
e
semaine. À partir du
ganglion rachidien, les fibres, qui expriment la substance
P, CGRP (calcitonin gene related protein) et somatosta-
tine, projettent dans la zone marginale ou lamina I
d’abord, puis dans la substance gélatineuse ou lamina II
de la corne dorsale de la moelle. Les projections des
fibres C constituent le dernier groupe d’afférences pri-
maires à pénétrer dans la moelle, après les fibres Aδ.
Le destin des neurones situés dans ces deux lamina,
activateur (glutamatergique) ou modulateur (gabaer-
gique), est déterminé par des molécules sélectrices et
par la compétition entre deux facteurs de croissance,
mt Médecine de la Reproduction, Gynécologie Endocrinologie, vol. 12, n° 2, avril-mai-juin 2010
Congrès de médecine fœtale 2010, Morzine
112
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

les neurotrophines I et II, qui détermineront le nombre
final des deux types de neurones. Par ailleurs, les neuro-
nes de la lamina I sont générés avant les interneurones,
la transmission des influx nociceptifs vers le système
nerveux central pouvant être effective avant la mise en
place des circuits neuromodulateurs locaux [6, 9, 15].
La maturation fonctionnelle progressive des circuits
nociceptifs correspond à la formation de synapses entre
afférences sensorielles et neurones spinaux, qui sont
responsables des premières réponses réflexes aux stimuli
nociceptifs et apparaissent à huit semaines de gestation
[2]. Le réflexe spinal devient évident à partir de la
26
e
semaine. La réaction fœtale aux stimuli peut être
globale, correspondant à la mise en jeu d’interconnexions
entre les différents niveaux segmentaires de la moelle
ou entre la moelle et le tronc cérébral. Ces réflexes de
survenue précoce ne sont pas le témoin d’un stimulus
nociceptif, car les fibres C qui médient la nociception
ne deviendront fonctionnelles qu’au cours de la 20
e
semaine de gestation. Par ailleurs, ces réponses, d’abord
disproportionnées par rapport au stimulus seront adaptées
après la 30
ème
semaine lorsque les synapses inhibitrices
fonctionnelles gabaergiques et glycinergiques seront en
place [8, 16]. Le contrôle des circuits nociceptifs par les
voies descendantes issues du tronc cérébral s’effectue par
des fibres excitatrices sérotoninergiques situées dans
la substance grise périaqueducale et des fibres inhibitrices
noradrénergiques qui se mettent en place relativement,
tardivement au cours de la grossesse (la sérotonine
permettant l’activation des récepteurs glutamatergiques
AMPA au niveau de la corne dorsale de moelle épinière)
[2, 6, 8, 9, 11, 15, 16].
Thalamus
Le thalamus constitue le relais spécifique pour les
voies de la sensibilité thermoalgique. Les afférences
sensitives parviennent au thalamus, en particulier au
niveau de la partie postérieure du noyau ventromédian
qui contient un plexus de fibres exprimant la calbindine
(sous-population gabaergique), la substance P et le CGRP
[17]. Les projections de la moelle vers le thalamus
commencent à se mettre en place à partir de sept semai-
nes, au moment où se forme dans la zone du manteau
cérébral la préplaque qui sera rapidement divisée en
une zone superficielle, future couche I contenant des
cellules de Cajal-Retzius et une zone profonde, la sous-
plaque. Il est à noter que les premières synapses mises
en évidence au niveau de la zone du manteau cérébral
apparaissent au niveau des neurones de la sous-plaque.
Les connections entre faisceau spinothalamique et neuro-
nes thalamiques sont en place à 20 semaines de gestation,
le faisceau spinothalamique se myélinise entre 22 et 29
semaines [1, 9].
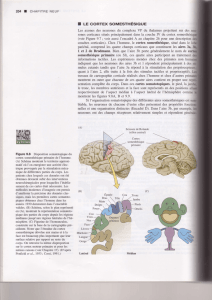
Organisation anatomique
des voies de la douleur
L’organisation anatomique des voies de la douleur est
fonctionnelle entre la 24
e
et la 30
e
semaine de vie
fœtale et permet de véhiculer l’influx nociceptif vers
les structures centrales. Sans les connexions entre le
thalamus et le cortex cérébral, il ne peut y avoir de
traitement de l’influx nociceptif [1, 8, 19]. Les premières
projections corticales apparaissent entre 12 et 16 semai-
nes, au moment de la migration radiaire des neurones
postmitotiques issus du neuroépithélium vers la plaque
corticale. Jusqu’à 22 semaines, les afférences thalamiques
sont connectées sur les neurones de la sous-plaque,
compartiment d’attente des fibres pendant plusieurs
semaines. Dès la 23
e
semaine de gestation, les premiè-
res synapses se forment avec les neurones du cortex
pariétal et c’est à ce moment, entre 23 et 25 semaines
de gestation, que les connexions entre les récepteurs
périphériques et la moelle parviennent à maturation
complète [2]. Les afférences thalamiques vers le cortex
visuel s’établissent entre 23 et 27 semaines d’aménor-
rhée (SA), vers le cortex auditif entre 26 et 28 SA et
vers le cortex préfrontal à partir de 29 SA. Les afférences
vers le cortex somatosensoriel sont visualisées à partir de
24 semaines de gestation, avec à partir de 26 semaines
une augmentation extrêmement importante de la densité
synaptique corticale. À 26 semaines, le thalamus et le
cortex cérébral ont une cytoarchitectonie comparable à
celle de l’adulte [2, 5, 8, 9, 15]. C’est à ce moment que
des potentiels évoqués somesthésiques visuels et auditifs
corticaux peuvent être enregistrés et qu’apparaissent
les phases d’éveil et de sommeil. Cependant, l’activité
synchrone entre les deux hémisphères ne sera présente
qu’à partir de 34 semaines, correspondant à la mise en
place des connexions calleuses intracorticales [2, 9, 10,
15, 16]. La sous-plaque commence à régresser à 32 SA.
Le rôle de ces neurones est encore partiellement connu.
Certains de ces neurones ont une fonction transitoire :
outre leur implication dans le guidage des neurones en
migration, ils pourraient également diriger la croissance
des afférences thalamiques vers les cibles synaptiques
définitives dans la plaque corticale, coordonner les
champs de réception et intervenir dans le processus
de gyrification. Les neurones qui persistent sont situés
entre les fibres corticales et restent connectés avec les
neurones des différentes couches du cortex [2, 9, 18].
De la nociception à la perception
consciente de la douleur
Vigilance et conscience
La vigilance, qui apparaît vers 30 semaines de gesta-
tion, n’est pas synonyme de conscience [2, 19]. La
mt Médecine de la Reproduction, Gynécologie Endocrinologie, vol. 12, n° 2, avril-mai-juin 2010 113
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

perception consciente de la douleur implique la mise
en jeu de phénomènes complexes au niveau du cortex
cérébral et en particulier un apprentissage préalable pour
identifier et reconnaître la douleur. Pour certains auteurs,
la douleur serait perçue à partir du moment où les fibres
thalamocorticales parviennent au cortex, soit entre
26 et 34 semaines de grossesse. Selon Fitzgerald [8], la
barrière de la 26
e
semaine de gestation semblerait
représenter le point de repère après lequel on peut parler
de douleur. Par ailleurs, la surface des champs de
projection des neurones sensoriels impliqués dans la
nociception est plus importante chez le fœtus, les conne-
xions centrales étant d’abord diffuses, suggérant que
le fœtus ne distingue pas un stimulus nociceptif d’un
stimulus non nociceptif ainsi que sa localisation précise.
Cependant, alors que la conscience n’est pas encore
développée, le fœtus peut se trouver dans un état de
stress négatif et souffrir alors qu’il ne perçoit pas encore
consciemment la douleur en réponse à un stimulus
nociceptif, comme en témoignent certains marqueurs
de stress tels que les perturbations hémodynamiques
cérébrales détectables dès 16 SA et les sécrétions
hormonales consécutives à la mise en jeu de l’axe
hypothalamohypophysosurrénalien et le système nerveux
autonome, détectées dès 20 SA. Ces réactions sont
considérées comme un phénomène adaptatif et consti-
tueraient un mécanisme d’épargne central [2, 5, 7, 15].
La conscience résulte d’une combinaison d’activités
cérébrales permettant à l’individu de donner une signifi-
cation et d’apporter une réponse appropriée à des
stimulations variées, visuelles, auditives, tactiles, qu’elles
soient nociceptives ou non. Elle permet de procéder
àl’analyse du vécu et de se projeter dans l’avenir,
grâce à la mise en jeu de compétences intellectuelles et
psychoaffectives personnelles [16, 20]. L’acquisition
de la conscience survient lorsque les circuits sont
totalement développés et fonctionnels et lorsque la
composante psychologique (émotions et sensations) est
en place, ce qui nécessite que la mémoire représentative
(faculté de répondre et d’apprendre à partir d’une
information stockée) soit développée [5]. Pour certains,
elle constituerait la pierre angulaire du développement
de la conscience et apparaît lorsque le cortex frontal se
développe. Elle nécessite en outre que l’hippocampe
qui facilite la formation, le stockage et le maintien des
souvenirs soit également fonctionnel [7].
Perception consciente de la douleur
Les différentes composantes participent aux circuits
constituant la conscience (cortex somatosensoriel, cortex
cingulaire antérieur, cortex insulaire antérieur et aire
prémotrice ventrale) et ont été dénommées global
neuronal workspace, représentation théorique de l’état
de conscience et théorie développée par Lagercrantz et
Changeux, appelée de façon métaphorique par Baars
« théâtre de l’esprit » [16]. Dans ce contexte, les percep-
tions multimodales, les émotions et les sentiments ainsi
que la mémoire et la motricité sont intégrés subjective-
ment dans un flux de conscience dynamique correspon-
dant au contenu de l’expérience consciente. Ces états de
la conscience sont contrôlés par le tronc cérébral, le
diencéphale et sont médiés par des interactions thalamo-
corticales (aires associatives supérieures, cortex préfron-
tal, cortex cingulaire et cortex pariétotemporal). La
mobilisation de ces circuits représente le signe objectif
d’accès à la conscience, et est détectée dans le cortex
préfrontal. Le global neuronal workspace est connecté
àd’autres systèmes spécialisés impliqués dans l’activité
motrice, l’attention, la mémoire, les facultés d’évaluation
et les perceptions. Ces dernières ne sont pas toutes
fonctionnelles au même moment chez le fœtus ou chez
le nouveau-né : l’audition se développe à partir de
16 semaines, la cochlée est structurée à 18 semaines,
le cortex auditif répond aux stimulations auditives à
partir de 26 semaines. Les potentiels évoqués auditifs
au niveau du tronc cérébral sont enregistrés à partir de
28 semaines et l’activation corticale est détectée à partir
de 33 semaines. L’olfaction se développe à partir de
20 semaines. La vision, quoique non développée, permet
de répondre à des stimuli visuels au moment de la
naissance. Chez le fœtus, une stimulation douloureuse
induit l’activation du cortex somatosensoriel, du cortex
cingulaire antérieur, du cortex insulaire antérieur et
de l’aire prémotrice ventrale (composantes du global
neuronal workspace) après 25 semaines [2, 16], suggé-
rant que la perception consciente est fonctionnelle
peu après le début de la seconde moitié de la gestation.
Conflit d’intérêts : aucun.
Références
1. Annequin D. Historique de la prise de conscience de la douleur
chez le foetus et le nouveau-né. XIV
e
journée de techniques
avancées en gynécologie obstétrique PMA et pédiatrie. Paris, 1999.
2. Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Fetal pain: a
systematic multidisciplinary review of the evidence. JAMA 2005 ;
294 : 947-54.
3. Weiss N, De Waard M. Voltage-dependant calcium channels at
the heart of pain perception. Med Sci 2006 ; 22 : 396-404.
4. Derbyshire SW. Can fetuses feel pain? BMJ 2006 ; 332 : 909-12
[BMJ 2006; 332(7548) : 1036].
5. Derbyshire SW, Furedi A. Do fetuses feel pain? “Fetal pain”is a
misnomer. BMJ 1996 ; 313 : 795.
6. Cahana A, Jones D. Neurobiology of the chronicisation of pain in
children: the memory of pain and its painful memory. Ann Fr
Anesth Reanim 2007 ; 26 : 540-5.
7. Lloyd-Thomas AR, Fitzgerald M. Do fetuses feel pain? Reflex
responses do not necessarily signify pain. BM 1996 ; 313: 797-98.
mt Médecine de la Reproduction, Gynécologie Endocrinologie, vol. 12, n° 2, avril-mai-juin 2010
Congrès de médecine fœtale 2010, Morzine
114
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

8. Fitzgerald M. The development of nociceptive circuits. Nat Rev
Neurosci 2005 ; 6 : 507-20.
9. Lowery CL, Hardman MP, Manning N, Hall RW, Anand KJ. Neu-
rodevelopmental changes of fetal pain. Semin Perinatol 2007 ; 31 :
275-82.
10. Mahieu-Caputo D. Fetal pain. Journal de Pédiatrie et de puéri-
culture 2005 ; 18 : 120-6.
11. Dougherty PM, Palecek J, Paleckova V, Sorkin LS, Willis WD.
The role of NMDA and non-NMDA excitatory amino acid receptors
in the excitation of primate spinothalamic tract neurons by mecha-
nical, chemical, thermal, and electrical stimuli. J Neurosci 1992 ;
12 : 3025-41.
12. Glover V, Fisk N. Do fetuses feel pain? We don’t know; better to
err on the safe side from mid-gestation. BMJ 1996 ; 313 : 796.
13. Hunt SP, Mantyh PW. The molecular dynamics of pain control.
Nat Rev Neurosci 2001 ; 2 : 83-91.
14. Zhang X, Bao L. The development and modulation of nocicep-
tive circuitry. Curr Opin Neurobiol 2006 ; 16 : 460-6.
15. Vanhatalo S, van Nieuwenhuizen O. Fetal pain? Brain Dev
2000 ; 22 : 145-50.
16. Lagercrantz H, Changeux JP. The emergence of human
consciousness: from fetal to neonatal life. Pediatr Res 2009 ; 65 :
255-60.
17. Blomqvist A, Zhang ET, Craig AD. Cytoarchitectonic and
immunohistochemical characterization of a specific pain and
temperature relay, the posterior portion of the ventral medial
nucleus, in the human thalamus. Brain 2000 ; 123 : 601-19.
18. KostovićI, Jovanov-MilosevićN. The development of cerebral
connections during the first 20-45weeks’gestation. Semin Fetal
Neonatal Med 2006 ; 11 : 415-22.
19. Mellor DJ, Diesch TJ, Gunn AJ, Bennet L. The importance of
‘awareness’for understanding fetal pain. Brain Res Brain Res Rev
2005 ; 49 : 455-71.
20. Searle JR. Consciousness. Annu Rev Neurosci 2000 ; 23 :
557-78.
mt Médecine de la Reproduction, Gynécologie Endocrinologie, vol. 12, n° 2, avril-mai-juin 2010 115
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
5
100%