COURS 5 PHYSIOPATHOLOGIE DE LA DOULEUR

1
Année universitaire 2014-2015
COURS 5
PHYSIOPATHOLOGIE DE LA DOULEUR
PLAN DU COURS:
I. L’apppareil sensoriel de la douleur
II. La modulation de la douleur
III. La sensibilité douloureuse
IV. Types de douleur
La douleur est un mécanisme de protection NON-SPECIFIQUE, représentant le
symptôme le plus commun des états pathologiques. Elle apparaît chaque fois dans le cas d’un
tissu lésé, en déterminant le sujet d’actionner pour l’éloignement du stimulus douloureux.
L’Association Internationale pour l’Étude de la Douleur a définit la douleur (1979) comme une
expérience sensorielle et emotionnelle désagréable déterminée par un stimulus nocif ou
potentiellement nocif .
I. L’APAREIL SENSORIEL DE LA DOULEUR
A. Les récepteurs pour la douleur (nocicepteurs)
Définition: Les nocicepteurs sont des terminaisons nerveuses libres ayant l’origine
dans les ganglions atachés aux fibres sensitives des nerfs spinaux et crâniens (n.V).
Classification:
fibres myéliniques minces de type A-: à une distribution exclusivement superficielle
(derme, hypoderme)
fibres amyéliniques de type C: à une distribution prédominante profonde, tant au niveau
des structures somatiques (muscles, tendons, ligaments, artiulations), qu’au niveau des
viscères
Caractéristiques
font partie de la catégorie des récepteurs polymodaux, qui répondent aux stimuli
mécaniques, thermiques et chimiques
sont des récepteurs toniques qui NE s’adaptent pas ou s’adaptent très peu
(déchargent des potentiels de récepteur tant que le stimulus douloureux actionne).
Les stimuli douloureux (algogènes): les stimuli capables d’induire des lésions
tissulaires
les stimuli de nature MÉCANIQUE: la pression intense sur le tégument, la contraction
violente ou l’extension extrème du muscle, les ruptures, les piqûres, la traction, le
compression, la distension de la capsule des viscères
les stimuli de nature THERMIQUE: les variations extrèmes de température
les stimuli de nature CHIMIQUE (les nocicepteurs font partie de la catégorie des
chimiorécepteurs) - sont des substances libérées des tissus lésés, ischémiés ou
enflammés. De celles-ci, les plus importantes sont:
DEPARTEMENT DES SCIENCES FONCTIONNELLES
PHYSIOPATHOLOGIE
Rue Tudor Vladimirescu, 14
300173 Timioara,
Tel/Fax: +40 256 493085

2
les amines biogènes - bradikinine (BK)
les dérivés de l’acide arachidonique - PGE2
produits des lésions cellulaires - K+, H+
neuropeptides – la substance P (SP) libérée du niveau des fibres C
B. Les voies de conduction nociceptives
(a) La voie ascendente - extranevraxiale
Comprend les dendrites et les axones des protoneurones du ggl.sensitif ataché aux nerfs
spinaux, en représentant les fibres de type A- et de type C, qui pénètrent par la racine
postérieure des nerfs spinaux et font synapse avec le deutoneurone de la voie nociceptive de
la lamine V des cornes postérieures.
Les fibres A-
– des fibres myéliniques minces (diamètre = 6 m) à grande vitesse de conduction (10-30
m/s)
se terminent dans la lamine I (lamina marginalis) des cornes postérieures et par des axones
courts font synapse avec le deutoneurone de la lamine V
conduisent la douleur RAPIDE
Les fibres C
– des fibres amyéliniques (diamètre 2 m) à petite vitesse de conduction (0,5–2,5 m/s)
se terminent dans les lamines II i III (la substance gélatineuse) des cornes postérieures et
par des axones courts font synapse avec le deutoneurone de la lamine V
conduisent la douleur LENTE
(b) La voie ascendente - intranevraxiale
Comprend les axones des deutoneurones des cornes postérieures, qui s’entrecroissent
et pénètrent dans les cordons latéraux du côté opposé et puis montent vers le troisième
neurone de la voie nociceptive, situé dans le thalamus. Les fibres nociceptives
intranevraxiales sont grupées dans le tractus néospinothalamique et paléo-
spinothalamique qui font partie du système ascendent des cordons antéro-latéraux (Fig.
1).
Figure 1. Les voies nociceptives intranevraxiales
(Adaptée après Guyton and Hall, Textbook of Medical Physiology,2006)
L’AIRE
SOMESTHESIQUE I
Complexe ven
tro
-
postérieur thalamique
Douleur
rapide
LE
SYSTÈME DES CORDONS
ANTÉRO
-
LATÉRAUX
La formation réticulée
Douleur
lente
HYPOTHALAMUS
Noyaux thalamiques
intralaminaires
THALAMUS
SYSTÈME LIMBIQUE
CORTEX D’ASSOCIATION

3
1. Le tractus NÉO-SPINOTHALAMIQUE
conduit les informations transmises par les fibres A- (douleur rapide)
comprend les axones des deutoneurones de la lamina marginalis qui font synapse dans le
thalamus latéral (le complexe ventro-postérieur thalamique)
les fibres thalamiques se projettent dans l’aire somesthésique I pariétale
la projection corticale est commune à la voie de la sensibilité tactile fine (les tractus
spino-bulbaires qui projettent dans l’aire somésthésique I les informations reçues des
fibres A-), transmises des récepteurs tactiles par le système ascendent des cordons
dorsaux assure la précision de la localisation et la perception de l’intensité et de la
qualité de la douleur rapide.
Conclusion:
La douleur rapide (les fibres A-) est une douleur bien localisée
Les informations transmises par le tractus néo-spinothalamique assurent la
perception sensorielle nociceptive
2. Le tractus PALÉO-SPINOTALAMIQUE
c’est une voie multisynaptique qui conduit les informations transmises par les fibres C
(douleur lente).
la plupart des fibres finissent dans le thalamus médial (les noyaux intralaminaires) et la
formation réticulaire (SRAA et les noyaux végétatifs)
a) les axones des neurones des noyaux intralaminaires se projettent dans le cortex
d’association, le système limbique et dans l’hypothalamus.
la projection des fibres thalamiques médiales dans le cortex d’association est
responsable pour l’expérience sensorielle nociceptive (la „signification” de
la douleur)
la projection dans le système limbique détermine la réaction affective-
émotionnelle associée à la douleur
la projection dans l’hypothalamus est responsable pour la réaction
végétative associée à la douleur
b) la projection corticale diffuse des axones des neurones de la formation réticulaire
(SRAA) induit l’état de “réveil” et d’“alerte” corticale et détermine l’anxiété et
l’insomnie qui accompagnent la douleur
une petite partie des fibres ascendentes du tractus paléo-spinothalamique font
synapse dans le complexe ventro-postérieur thalamique et se projettent au niveau de
l’aire somesthésique I
Conclusion:
La douleur lente (fibres de type C) est une douleur faiblement localisée
les informations transmises par le tractus paléo-spinothalamique assurent
l’expérience sensorielle nociceptive
la perception affective émotionnelle de la douleur
II. LA MODULATION DE LA DOULEUR
La modulation de la douleur consiste dans la facilitation ou l’inhibition de la
transmission de l’excitation nociceptive par des mécanismes périphériques (modulation
périphérique) et/ou centraux (modulation centrale).

4
1. La modulation PÉRIPHÉRIQUE - La sensibilisation périphérique des nocicepteurs
Définition: représente un mécanisme de facilitation de la transmission de l’excitation
nociceptive par la persistence des lésions inflammatoires ou irritatives au niveau
d’un tissu péripherique.
Mécanisme PATHOGÉNIQUE:
la baisse du seuil d’excitation des nocicepteurs - par la libération prolongée des
facteurs algogènes: - la bradykinine (sourse: endothélium)
- PGE2 (source: endothélium et mastocytes)
- H+ et K+ (source: celluled détruites)
- substance P (source: les terminaisons nerveuses libres de type C dans
l’inflammation neurogène)
l’activation des „nocicepteurs silencieux” aux stimuli mécaniques inofensifs - les
terminaisons nerveuses libres ayant le rôle de mécanorécepteurs deviennent sensibles
dans la présence de l’inflammation à l’activité mécanique normale des viscères. Par ex.,
les mouvements péristaltiques de l’intestin deviennent douloureux (coliques
intestinales) dans les maladies inflammatoires intestinales.
À retenir!
L’excitation prolongée des fibres nociceptives C, comme résultat d’une lésion tissulaire
persistente détermine la libération rétrograde (par réflexe d’axone) de la substance
P, qui:
- détermine la dégranulation des mastocytes et la libération de l’histamine
- détermine la libération du niveau des cellules endothéliales des médiateurs
responsables pour la vasodilatation et l’augmentation de la perméabilité
capillaire (NO, bradykinine).
Conséquence: une réaction inflammatoire locale appellée inflammation neurogène
qui sensibilise les nocicepteurs par un mécanisme périphérique
2. La modulation CENTRALE
Définition: C’est le mécanisme par lequel est facilitée ou inhibée la transmission de
l’excitation au niveau des synapses entre le premier et le deuxième neurone de la voie
nociceptive. Au niveau de ces synapses, le principal neurotransmetteur est le
glutamate (GLU), libéré des vésicules du bouton présynaptique (protoneurone) à
cause de l’augmentation de la concentration du Ca2+ cytosolique. Le GLU peut se fixer
sur 2 types de récepteurs du niveau de la membrane post-synaptique
(deutoneurone)(Fig. 2):
rec. AMPA (-Amino-hidroxi-Metil-izoxazol-Propionic Acid) – un récepteur-canal ionique
de Na+
rec. NMDA (N-metil-D-aspartat) – un récepteur-canal ionique de Na+ , Ca2+ et Mg2+ qui
nécessite pour activation la dépolarisation prolongée de la membrane post-synaptique.

5
Figure 2. Les récepteurs postsynaptiques du glutamate
(Modifiée après Robert C. Malenka, et al. Long-Term Potentiation: A Decade of Progress? Science: 1999; 285, 1870)
(a) La sensibilisation au niveau spinal
Mécanisme PATHOGÉNIQUE
Un stimulus douloureux à durée et intensité petite détermine la libération de GLU
dans la fente synaptique. Celui-ci actionne sur les réc.AMPA et détermine une
dépolarisation post-synaptique de courte durée par influx de Na+.
Un stimulus douloureux à durée et intensité grande (stimulus généré par un
nocicepteur sensibilisé périphérique) suppose la libération dans la fente synaptique de
GLU et de substance P. La substance P a le rôle d’un cotransmetteur
- La SP actionne sur les réc. NK1 (neurokinine 1) du niveau post-synaptique et
génère un influx supplémentaire de Na+
- Le GLU actionne sur les réc. AMPA et détermine un influx de Na+ post-
synaptique de courte durée
Conséquence: La dépolarisation post-synaptique prolongée par l’action simultanée
du GLU et de la SP, permet:
- l’activation des réc. NMDA par GLU
- la facilitation de la transmission synaptique à la base d’un influx massif de Na+
, Ca2+ et Mg2+ post-synaptique
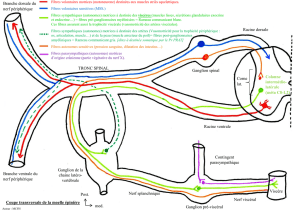
(b) „La théorie de la porte de contrôle”
Conformément à cette théorie „la porte”, représentée par la synapse entre le
protoneurone et le deutoneurone de la voie nociceptive, a une dynamique contrôlée
par les interneurones inhibiteurs opiatergiques nommés cellules G. Ces cellules,
situées dans la lamine II et III (substance gélatineuse), ont comme neurotransmetteur
des enképhalines qui exercent un effet d’inhibition présynaptique de la
transmission de l’exitation au niveau de la porte de contrôle.
Les cellules G reçoivent deux types d’afférences du niveau des récepteurs
périphériques (Fig. 3):
fibres myélinisées de type A- (vitesse augmentée) qui desservent les récepteurs
tactiles (Meissner i Merkel) et qui „ferment la porte” par l’augmentation de la fréquence
de décharge des cellules G
fibres amyéliniques de type C (vitesse baissée) qui conduisent l’exitation douloureuse et
qui „ouvrent la porte” par la baisse de la fréquence de décharge des cellules G
Dépolarisation de
courte durée
Dépolarisation
prolongée
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%