le systeme urinaire

1
LE SYSTEME URINAIRE
Le métabolisme des substances nutritives entraîne la production de déchets par les cellules
de l'organisme : le gaz carbonique, l'excès d'eau et la chaleur. En outre, le catabolisme des
protéines produit des déchets azotés toxiques tels que l'ammoniac et l'urée. Par ailleurs, des
ions essentiels, tels le sodium (Na+), le chlorure (Cl-), le sulfate (S042-), le phosphate
(HPO42-) et l'hydrogène (H+), ont tendance à s'accumuler en quantité excessive. Toutes les
substances toxiques, de même que toutes les substances essentielles excédentaires doivent
être excrétées (éliminées) de l'organisme. Plusieurs organes participent à l'élimination des
déchets De l'organisme :
1. Les reins. Excrètent l'eau, les déchets azotés issus du catabolisme des protéines, certaines
toxines bactériennes, des H+ et des sels minéraux (électrolytes), ainsi qu'une certaine quantité
de chaleur et de gaz carbonique.
2. Les poumons. Excrètent du gaz carbonique, de la chaleur et une petite quantité d'eau.
3. La peau (les glandes sudoripares). Excrètent de la chaleur, de l'eau et du gaz carbonique,
ainsi que de petites quantités de sels et d'urée.
4. Le tube digestif. Élimine des déchets solides non digérés, et excrète du gaz carbonique, de
l'eau, des sels et de la chaleur.
Le rôle principal du système urinaire consiste à maintenir
l'homéostasie de l'organisme en réglant la composition, le
volume et la pression du sang.
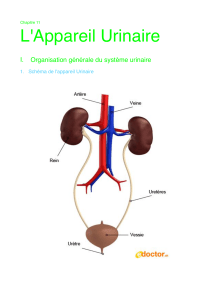
Pour ce faire, il élimine et restitue des quantités déterminées d'eau et de solutés. Le système
urinaire est formé de deux reins, de deux uretères, d'une vessie et d'un urètre (figure 1). Les
reins ont plusieurs fonctions:
1. Le volume et la composition du sang.
Les reins règlent la composition et le volume du sang, et évacuent les déchets issus du sang
sous forme d'urine. Ils éliminent une quantité sélective de divers déchets, y compris un excès
de H+, ce qui contribue à la régularisation du pH sanguin.

2
2. La pression sanguine.
Ils contribuent à la régulation de la pression sanguine en sécrétant une enzyme, la rénine,
qui active le système rénine-angiotensine.
3. Le métabolisme.
Les reins contribuent au métabolisme par a) la réalisation de la néoglucogenèse (la synthèse
de nouvelles molécules de glucose) pendant l'inanition ou le jeûne, b} la sécrétion de
l'érythropoïétine, qui stimule la production des globules rouges, et c} la participation à la
synthèse du calcitriol, la forme active de la vitamine D.
L'urine est excrétée de chaque rein par son uretère et est emmagasinée dans la vessie
avant d'être évacuée hors de l'organisme par l'urètre. Lorsque les reins ne sont pas en
mesure d'éliminer continuellement les déchets, il en résulte l'urémie (emia: condition du
sang), état caractérisé par un taux toxique d'urée dans le sang.
La néphrologie (neph : rein ; logos: étude de) est la branche spécialisée de la médecine
qui traite de la structure, de la fonction et des maladies du système urinaire de l'homme et de la
femme, et du système reproducteur de l'homme. L'urologie (uro : urine ou voies urinaires) est
la branche spécialisée de la chirurgie reliée aux systèmes urinaires de l'homme et de la femme,
et au système reproducteur de l'homme.
I-LES REINS
Les reins, au nombre de deux, sont des organes rougeâtres dont la forme rappelle celle d'un
haricot. Ils sont situés immédiatement au-dessus de la taille, entre le péritoine pariétal et la
paroi postérieure de l'abdomen (figure 2). Puisqu' ils sont situés derrière le péritoine tapissant
la cavité abdominale, on dit qu'ils sont rétropéritonéaux. Les uretères et les glandes
surrénales sont aussi des organes rétro- péritonéaux. Par rapport à la colonne vertébrale, les
reins sont situés entre la dernière vertèbre thoracique et la troisième vertèbre lombaire.
Ils sont aussi partiellement protégés par la onzième et la douzième paire de côtes. Le rein
droit est légèrement abaissé par rapport au rein gauche, à cause du grand espace qu' occupe le
foie du côté droit.
I- L'ANATOMIE EXTERNE
Chez l'adulte, les reins mesurent en moyenne de 10 à 12 cm de longueur, de 5,0 à 7,5 cm de
largeur et 2,5 cm d'épaisseur. Le bord interne concave fait face à la colonne vertébrale (figure
3). Près du centre de ce bord concave se trouve une échancrure appelée hile, par laquelle

3
l'uretère quitte le rein. Les vaisseaux sanguins et lymphatiques ainsi que les nerfs pénètrent
dans le rein et en sortent également par le hile. Le hile s'ouvre sur une cavité dans le rein,
appelée sinus rénal (figure 4).
Trois couches de tissus entourent les reins. La couche interne, la capsule rénale, est une
membrane fibreuse lisse et transparente qui est en continuité avec la couche externe de
l'uretère au niveau du hile. Elle sert de barrière contre les traumatismes et empêche la
propagation des infections au rein. La couche moyenne, la capsule adipeuse, est une masse
de tissu adipeux entourant la capsule rénale. Elle protège également le rein contre les
traumatismes, tout en le maintenant fermement en place à l' intérieur de la cavité abdominale.
La couche externe, le fascia rénal, est une fine couche de tissu conjonctif dense irrégulier qui
fixe le rein aux organes adjacents et à la paroi abdominale.
Application clinique
LA NÉPHROPTOSE (LE REIN FLOTTANT)
La néphroptose (ptosis: tomber) ou rein mobile, ou rein flottant, est un abaissement ou
une descente du rein. Elle se produit lorsque le rein n'est plus fermement maintenu en
place par les structures adjacentes ou sa couche adipeuse et qu'il glisse hors de sa
position normale. La néphroptose peut se produire chez les personnes dont la capsule
adipeuse ou le fascia rénal présente une déficience, surtout celles qui sont maigres. La
néphroptose est dangereuse, car elle peut causer l'entortillement de l'uretère, qui entrave
le flux urinaire. Le reflux de l'urine qui en résulte exerce une pression sur le rein, ce qui
porte atteinte au tissu rénal. La douleur se manifeste également lorsque l'uretère est
tordu.
I-2)L’ANATOMIE INTERNE
Une coupe frontale d'un rein montre une région externe rougeâtre, appelée cortex, et une
région interne brun rougeâtre, appelée médulla (figure 4). À l'intérieur de la médulla, se
trouvent de 8 à 18 structures triangulaires striées appelées pyramides rénales
(médullaires). Leur aspect strié s'explique par la présence de tubules droits et de
vaisseaux sanguins. Les bases des pyramides font face au cortex, tandis que leurs
sommets, appelés papilles rénales, sont orientés vers le centre du rein. Le cortex est la
région d'aspect lisse qui s'étend de la capsule rénale aux bases des pyramides et dans les
espaces entre celles-ci. Il se divise en deux parties : une région corticale externe et une

4
région juxta-médullaire interne. Des portions du cortex se prolongent entre les pyramides
rénales pour former les colonnes rénales.
Ensemble, le cortex et les pyramides rénales forment le parenchyme (partie fonctionnelle)
du rein. Du point de vue structural, le parenchyme rénal contient approximativement un
million de structures microscopiques appelées néphrons, qui sont les unités fonctionnelles
du rein.
À l'intérieur du sinus rénal se trouve une grande cavité appelée bassinet (pelvis rénal). Le
bord du bassinet renferme des prolongements caliciformes appelés grands calices et petits
calices (calyx: coupe). On trouve 2 ou 3 grands calices et de 8 à 18 petits calices. Chaque
petit calice reçoit l'urine des tubules collecteurs d'une pyramide et la déverse dans un
grand calice. L'urine s'écoule ensuite dans le bassinet et est évacuée vers la vessie par
l'uretère.
I-3)LE NEPHRON
Le néphron est l'unité fonctionnelle du rein. Un néphron a trois fonctions principales: la
filtration, la sécrétion et la réabsorption. Au cours de la filtration, certaines substances
peuvent passer du sang dans les néphrons, tandis que d'autres en sont empêchées. Ensuite,
à mesure que le liquide filtré (filtrat) se déplace à travers les néphrons, il reçoit d'autres
substances (déchets et excès de substances) ; c'est ce qu' on appelle la sécrétion. Le
processus par lequel d'autres substances (substances utiles) sont retournées au sang est la
réabsorption. L'urine est formée à la suite de ces activités des néphrons.
I-3-a) Les parties du néphron
Le néphron est constitué de deux parties: un corpuscule rénal (corpus: corps; ulus: petit)
qui filtre le liquide, et un tubule rénal dans lequel passe le liquide filtré (figure 5).
Le corpuscule rénal est composé de deux parties: une masse de capillaires artériels, appelée
glomérule (glomus : boule; ulus: petit), entourée d'une structure épithéliale à double
paroi, en forme de coupe appelée capsule glomérulaire ou capsule de Bowman. Leur
disposition est analogue à celle d'un poing (glomérule) que l'on enfoncerait dans un ballon
flasque (mais pas un ballon de foot ! SVP, ras le bol du foot !) (capsule glomérulaire) jusqu'à
ce qu'il soit recouvert par deux couches de ballon séparées par un espace. Les glomérules
sont des réseaux capillaires; ils font donc partie du système cardiovasculaire. Le sang
pénètre dans un glomérule par une artériole afférente et en sort par une artériole efférente.

5
La paroi externe de la capsule glomérulaire, ou feuillet pariétal, est séparée de la paroi
interne, appelée feuillet viscéral, par l'espace capsulaire, ou espace de Bowman (figure 6). À
mesure que le sang s'écoule dans les capillaires glomérulaires, l'eau et la plupart des solutés
du plasma sanguin passent dans l'espace capsulaire. Les grosses protéines plasmatiques et les
éléments figurés du sang ne traversent habituellement pas les parois des capillaires.
De l' espace capsulaire, le liquide filtré est transporté jusqu'au tubule rénal, qui comporte
trois segments principaux qui sont dans l'ordre: a) un tubule contourné proximal, b) une
anse de Henlé et c) un tubule contourné distal. Le tubule est dit contourné, car il est
sinueux plutôt que droit. Le terme proximal désigne la partie du tubule attachée à la capsule
glomérulaire, et distal, la partie qui en est la plus éloignée. Le corpuscule rénal et les deux
tubules contournés se retrouvent dans le cortex du rein, tandis que l'anse de Henlé
s’étend dans la médulla, effectue un virage en épingle à cheveux et retourne au cortex.
De courts tubules de raccordement relient les tubules contournés distaux de plusieurs néphrons à un
seul tubule collecteur. Les tubules collecteurs se rejoignent ensuite jusqu' à ce qu'ils ne constituent
plus que quelques centaines de gros conduits papillaires, qui se déversent dans les petits calices.
Les tubules collecteurs et les conduits papillaires s'étendent depuis le cortex jusqu' au bassinet. Il y a
en moyenne 30 conduits papillaires par papille rénale. Chaque rein contient environ un million de
corpuscules rénaux, de tubules contournés proximaux, d'anses de Henlé et de tubules contournés
distaux, mais beaucoup moins de tubules collecteurs et encore moins de conduits papillaires.
I-3-b) Les néphrons corticaux et juxta-médullaires
Dans un néphron, l'anse de Henlé relie les tubules contournés proximal et distal. La première
partie de l'anse descend profondément dans la médulla, où elle est appelée branche descendante de
l'anse de Henlé. Le tubule se courbe ensuite pour adopter la forme d'un U et retourne au cortex sous
le nom de branche ascendante de l'anse de Henlé. Les anses de Henlé sont courtes dans certains
néphrons et longues dans d'autres. Un néphron cortical a habituellement son glomérule dans la
région externe du cortex; sa courte anse de Henlé ne pénètre que dans la région externe de la
médulla (figure 5). En général, un néphron juxta médullaire (juxta : à côté de) a son glomérule dans
la région profonde du cortex à proximité de la médulla, alors que sa longue anse de Henlé s' étend
dans la médulla et atteint presque les papilles rénales (figure 6). De l5 à 20% des néphrons (juxta-
médullaires) dans le rein humain ont des anses longues. Ces néphrons à anses longues permettent
aux reins d'excréter une urine très diluée ou très concentrée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%