DM n°1

1/3
DM n°1 : Electricité (Oscillateurs libres amorties) – Chimie organique (Réactions d’Additions – Eliminations)
→ pour le Vendredi 16/09/16
Partie I : Condensateur de sécurité dans un circuit RL
On étudie un circuit RL série alimenté par un générateur de tension continue E (voir circuit-ci-contre).
L’interrupteur K est fermé depuis longtemps de sorte que le régime permanent est atteint.
1. Déterminer en fonction de E et R, la valeur de l’intensité traversant dans le circuit juste avant
l’ouverture de l’interrupteur.
2. A l’instant t=0 pris comme origine des temps, on ouvre l’interrupteur K. Quand l’interrupteur est fermé, il se comporte
simplement comme un fil. Mais quand l’interrupteur est ouvert, il faut prendre en compte la résistance Ra de l’air (très grand
et pouvant tendre vers l’infini) entre ses bornes.
Montrer que l’équation différentielle en i(t) dans le circuit (après ouverture de K) peut s’écrire sous la forme
. On
exprimera et K’ en fonction de E, L, R et Ra.
3. Déterminer complétement i(t).
4. En déduire u(t) la tension aux bornes de l’interrupteur. Que vaut alors u(0+) ? Sachant que Ra>>R, quel est le risque aux bornes
de l’interrupteur ?
Pour éviter le risque déterminé à la question précédente, on place en parallèle de l’interrupteur un
condensateur de capacité C. Il n’est donc plus nécessaire de prendre en compte la résistance Ra. Quand
l’interrupteur est fermé, le condensateur est court-circuité et on retrouve bien le circuit R,L série. Il n’intervient
donc que lors de l’ouverture de celui-ci (voir ci-contre).
5. Pour t < 0, le condensateur est déchargé et l’interrupteur fermé depuis longtemps. On l’ouvre à t = 0
et ce, pour toute la suite du problème. Déterminer alors et
en fonction de E, R et C.
6. Déterminer .
7. Montrer que l’équation différentielle à laquelle obéit u(t) peut s’écrire sous la forme
.
On exprimera et en fonction de R, L et C.
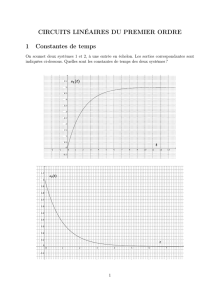
8. Le graphe représentant u(t) est donné ci-contre.
a. Déterminer la forme générale de u(t). Faire apparaître
un coefficient d’amortissement et une pulsation
propre en fonction de et . On ne cherchera pas à
trouver les deux constantes dépendant des conditions
initiales.
b. On considère que Q >> 1. Comment peut-on en être
certain en visualisant le graphe ? Dans cette hypothèse,
exprimer la pseudo-période T simplement en fonction
de . Déterminer T et en déduire une valeur
numérique pour .
9. On définit le décrément logarithmique par
. Déterminer sur le graphe et en déduire E. Montrer
(calculatoire) que pour Q >> 1, on peut écrire
.
10. Mesurer graphiquement et en déduire numériquement Q.
11. Sachant que , déduire des expressions de et , les valeurs de L et C utilisées dans le circuit.

2/3
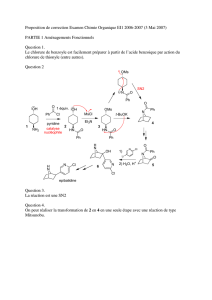
Partie II : Synthèse d’un dipeptide : l’hippurylphénylalanine
On s’intéresse à la préparation d’un dipeptide, l’hippurylphénylalanine 1 (voir Figure 1 ci-dessous). Ce composé est un substrat de la
carboxypeptidase A, un enzyme qui réalise l’hydrolyse des protéines au niveau de l’acide aminé C-terminal lorsque celui-ci possède
un résidu soit aromatique, soit aliphatique.
La première étape de la synthèse consiste à faire réagir du chlorure de benzoyle 3 et de la glycine 2. On obtient ainsi de l’acide
hippurique 4 qui, traité par du chlorure de thionyle SOCl2, donne le composé 5. Ce dernier réagit ensuite avec le composé 6 pour
donner l’amide 7. Une dernière étape permet d’obtenir l’hippurylphénylalanine 1.
Figure 1 : Synthèse de l’hippurylphénylalanine
I. Introduction sur les acides aminés : cas de l’acide aspartique
L’acide aspartique, acide aminé dont la chaîne latérale est -CH2COOH, est un triacide dont les pKa sont : pKa1 = 1,9 ; pKa2 = 3,7 ;
pKa3 = 9,6.
1. Quelle est la forme prédominante de l’acide aspartique à pH = 7 ? Justifier. On donnera la structure de l’espèce prédominante.
Données : pKA (RCOOH/RCOO-) ≈ 4 à 5 ; pKA (RNH3+ /RNH2) ≈ 9-10.
2. Donner en projection de Fisher, puis la représentation de Cram, du (L)-acide aspartique. Cette molécule est-elle chirale ?
3. Le spectre RMN de l’acide aspartique présente notamment les signaux suivants :
Signal 1 : singulet large à 11 ppm, intégration 2 ;
Signal 2 : doublet à 2,7 ppm, intégration 2 ;
Signal 3 : singulet très large à environ 2 ppm, intégration 2.
Attribuer ces signaux et interpréter les déplacements chimiques ainsi que la multiplicité des pics.
Données de R.M.N. :
Type de proton
(ppm)
Carbonyle RCH2CR=O
2,0 - 3,0
Acide RCO2H
9,5 - 13
Amine RNH2
1,0 – 5,0

3/3
II. Première étape : préparation de l’acide hippurique 4 à partir de la glycine 2 et du chlorure de benzoyle 3 (voir Figure 1)
De la glycine 2 (n2 = 1,0 mol) est dissoute dans une solution aqueuse d’hydroxyde de
sodium (n1 = 1,2 mol dans 0,60 L d’eau). À cette solution homogène, maintenue à une
température inférieure à 30◦C, sont ajoutés simultanément, sur une durée d’une heure, une
quantité n3 = 1,1 mol de chlorure de benzoyle 3 et 0,20 L d’une solution d’hydroxyde de
sodium de concentration c ≈ 10 mol.L−1. Un contrôle du pH montre qu’ainsi, le milieu
reste basique (pH > 10) au cours de la réaction. Une fois l’addition des réactifs achevée, le milieu réactionnel est encore agité pendant
trente minutes puis il est versé dans un becher contenant 125 mL de solution concentrée de chlorure d’hydrogène de concentration c ≈
12 mol L−1 (« acide chlorhydrique concentré »). Après filtration et purification, on obtient alors un solide, l’acide hippurique 4.
4. Donner le mécanisme de formation et la structure du produit obtenu en faisant réagir du chlorure de benzoyle (dont la structure
est donnée sur la Figure 1) avec de la méthanamine CH3NH2 en présence de pyridine.
5. Montrer que la glycine avant l’introduction du chlorure de benzoyle dans le milieu réactionnel est sous forme anionique.
Donner la structure de cet anion et justifier la réponse.
6. Identifier les sites nucléophiles de la glycine en milieu basique (pH > 10). Quel site nucléophile de la glycine est impliqué dans
la formation de l’acide hippurique 4 ?
7. ** Proposer un mécanisme permettant d’obtenir 4. Indication : on indique que le mécanisme fait intervenir
deux additions-élimination successives et que l’on passe par l’intermédiaire cyclique ci-contre.
8. Pourquoi le pH du milieu réactionnel ne doit-il pas devenir acide au cours de cette transformation ?
9. Donner la structure de la molécule 5, obtenue en faisant réagir le chlorure de thionyle sur l’acide hippurique
4, et écrire le bilan de la réaction correspondante.
III. Élaboration du composé 7 (voir Figure 1)
Le composé 6 est préparé par action du méthanol, introduit en excès, sur la phénylalanine racémique. La réaction est effectuée en
milieu acide. Après traitements, on isole avec un rendement supérieur à 96 % le produit 6, un solide ionique de formule brute
C10H14NO2Cl. Sur le spectre de RMN du proton de 6, on note la présence d’un signal singulet fin d’intégration 3H à δ = 3,7 ppm.
10. a. Écrire le bilan de la transformation qui aurait eu lieu, si, au lieu de la phénylalanine, l’acide
phényléthanoïque (dont la structure est précisée ci-dessous) avait été traité par le méthanol en excès,
en milieu acide. Quel est le nom de cette transformation ? Rappeler le mécanisme.
b. Citer un autre moyen permettant de synthétiser un ester méthylique. Rappeler le mécanisme en partant toujours de l’acide
phenyléthanoïque.
11. Donner la structure exacte du composé 6 et interpréter la donnée de spectroscopie RMN.
12. Quel est l’intérêt d’utiliser un large excès de méthanol dans cette transformation ? Quel est l’intérêt de se placer en milieu
acide pour cette transformation ?
Les composés 5 et 6 sont dissous en quantités équimolaires dans du DMF (solvant : N,N -diméthylméthanamide) en présence de
pyridine. Après agitation, l’amide 7 est obtenue.
13. Donner la structure de la molécule 7 et écrire le bilan de la formation du composé correspondant.
IV. Obtention de l’hippurylphénylalanine
L’amide brut 7 est saponifiée dans un mélange eau-méthanol (solvant) en présence d’hydroxyde de sodium (concentration finale voisine
de 1 mol L−1). Après chauffage à reflux du milieu pendant trois heures, de l’acide chlorhydrique est ajouté jusqu’à pH voisin de 2. Le
solide 1 se forme, il est isolé et purifié par redissolution en milieu basique aqueux puis reprécipitation en milieu acide.
14. Rappeler le mécanisme pour la transformation réalisée en milieu basique.
4: acide hippurique
acide phenyléthanoïque
1
/
3
100%