pharmacovigilance vaccins 2016 H Peyriere

1
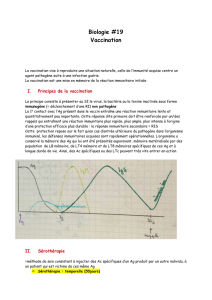
Les vaccins :
pharmacovigilance / cas
clinique
Dr H. PEYRIERE
Laboratoire de pharmacie clinique
CHU Montpellier
2016

•Pharmacovigilance :
ensemble des techniques
d’identification, d’évaluation et
de prévention du risque
d’effets indésirables
médicamenteux
En France, réseau de 31
Centres
Régionaux
de
2
Généralités
Centres
Régionaux
de
Pharmacovigilance
Surveillance des effets
indésirables des médicaments
en post-AMM

Généralités
•Vaccins = médicaments
•Vaccin : sujets en bonne santé, jeunes
•Population vaccinée variée (NN personne âgée),
•Bénéfice individuel différé ou inconnu /risque immédiat
•Profil de tolérance doit être excellent pour faire accepter la
stratégie
vaccinale
3
stratégie
vaccinale
•Estimation de tolérance / surveillance intensive et systématique
d’éventuels effets rares et graves après AMM : Pharmacovigilance
•Déclaration effets indésirables aux CRPV
•Études de pharmaco-épidémiologie
•Contre-indications et précautions d’emploi (RCP) systématiquement
vérifiées (allergie, immunodépression, épilepsie…)

Généralités / objectifs
•Pharmacovigilance des vaccins
•vise à détecter rapidement les événements indésirables pour déclencher
une évaluation précise des risques et une réponse appropriée (gestion
des risques) au problème.
•Minimiser les effets négatifs sur les individus.
•
Réduire
l'impact
négatif
potentiel
sur
les
programmes
de
vaccination
.
4
•
Réduire
l'impact
négatif
potentiel
sur
les
programmes
de
vaccination
.

Les systèmes d’alerte
1. La notification spontanée
•Déclaration de tout effet indésirable / vaccins aux CRPV
•Déclaration / professionnels de santé ou patients
•Déclaration obligatoire pour tout effet indésirable
•Seuil moyen de dépister une alerte / vaccin
Déclaration
EI
:
unique
façon
d’identifier
les
risques
rares
liés
à
la
vaccination,
en
5
•
Déclaration
EI
:
unique
façon
d’identifier
les
risques
rares
liés
à
la
vaccination,
en
situation de prescription courante éventuelle prise de décision de santé publique
•Non exhaustive : environ 10% des EI graves sont notifiés
•Manque de temps, mauvaise compréhension de son intérêt, lien non fait entre médicament
et effet observé
•Vaccins : Sujets jeunes, vaccination recommandée / autorités
•Suivi systématique des données post-AMM
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%