Lire l`article complet

ACTUALITÉ
a thérapie génique est une stratégie
thérapeutique dont l’objectif est l’ad-
ministration d’acides nucléiques afin de
modifier, plus ou moins durablement, le
patrimoine génétique de cellules-cibles.
Elle s’applique légitimement au traitement
des maladies génétiques, mais représente
aussi une alternative thérapeutique possible
pour certaines pathologies acquises. Les
premiers protocoles de thérapie génique ont
débuté en septembre 1990. Depuis huit ans,
plus de trois mille patients ont été inclus
dans plus de 300 études (1).
La thérapie génique se définit comme la
possibilité de transfert de gènes pour le trai-
tement de pathologies systémiques ou
focales, dont l’origine n’est pas obligatoire-
ment liée à une origine génétique (2). Plus
qu’une alternative, elle représente un véri-
table complément à la thérapie “classique”.
Principes
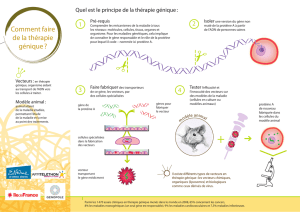
Le principe de thérapie génique consiste à
transférer un gène étranger à une population
cellulaire définie grâce à un vecteur, et à faire
surexprimer ce gène par la population cellu-
laire visée. Le rôle du vecteur est de faciliter
la pénétration cellulaire du transgène. Ce
vecteur est constitué de la région codante du
gène recombinant (gène d’intérêt) associé,
dans la construction vectorielle, à une ou plu-
sieurs séquences de gènes régulateurs. Le
vecteur peut être de nature virale ou non vi-
rale (2). Après pénétration cellulaire, le gène
à surexprimer doit échapper aux actions des
enzymes lysosomiales, franchir la membrane
nucléaire, éviter la dégradation liée aux
endonucléases, puis être exprimé (3). Cela
implique le développement, la mise au point,
puis la validation préliminaire d’une cons-
truction vectorielle avant toute transfection.
Elle peut être réalisée in vivo, soit par une
administration locale au sein du tissu concer-
né, soit par une administration systémique,
soit par transplantation de cellules transfec-
tées ex vivo (2). La thérapie génique permet
de développer une stratégie thérapeutique
palliant le défaut ou la déficience d’un gène
(2-4). Le champ d’application de la thérapie
génique est potentiellement très large.
Certaines pathologies systémiques peuvent
être traitées par thérapie génique (défaut de
l’expression de certains gènes : hémophilie,
certains types de cancers). En pathologie
cardiovasculaire, un traitement local peut
s’appliquer à de nombreuses situations : pré-
vention de la resténose après angioplastie
(5, 6),limitation de l’évolution de l’athéro-
sclérose (7),prise en charge de cardiopathies
ischémiques situées au-delà de toute revascu-
larisation conventionnelle (8),traitement
d’hypercholestérolémies familiales avec
déficit en récepteur aux LDL (9),ou traite-
ment des artérites sévères (10, 13).
Les deux difficultés de la thérapie génique
concernent d’abord la spécificité de la cible
cellulaire visée et la durée de surexpression
du gène et, ensuite, la nature du gène à sur-
exprimer. Dans le cas de pathologies liées à
la déficience d’expression d’un gène (com-
me l’hémophilie), le vecteur doit permettre
l’expression du gène déficitaire. Dans le cas
de pathologies acquises (resténose après
angioplastie par exemple), la nature du gène
à surexprimer n’est plus aussi “évidente”.
Cela implique une connaissance, la plus
complète possible, du processus physiopa-
thologique concerné. Or, ces pathologies
acquises sont généralement la conséquence
de cascades d’interactions complexes et non
totalement élucidées. Actuellement, c’est à
ce niveau que sont centrés les principaux
axes de recherche (4).
Les limites de la thérapie génique provien-
nent, in vivo, de l’adaptation des organismes
contre les agressions extérieures et environ-
nementales (en particulier, contre les incor-
porations d’ARN ou d’ADN étrangers dans
leurs génomes). En revanche, la thérapie
génique semble être liée à un faible risque de
réactions adverses. Dans ces conditions,
le rapport bénéfice/risque du traitement
génique est favorable. Néanmoins, après le
recul de nombreuses études in vitro, puis in
vivo, tant chez l’animal que chez l’homme,
la première Gene Therapy Policy Confe-
rence organisée en 1997 exclut l’usage de la
thérapie génique pour des raisons “fonction-
nelles” ou “cosmétiques” (1).
Différents types de vecteurs
Ils sont classés en vecteurs viraux ou non
viraux (tableau I, p. 186).
Vecteurs viraux
Ils utilisent la propriété naturelle des virus à
pénétrer et à modifier la séquence génomique
des cellules-cibles. La construction vecto-
rielle virale a pour but de permettre la trans-
fection cellulaire et l’expression du transgène,
tout en n’autorisant pas la prolifération virale.
Les vecteurs rétroviraux permettent le
transfert de simples brins d’ARN qui sont
traduits, via la reverse transcriptase,en
ADN double brin, intégré ensuite dans le
génome cellulaire. Ils sont les premiers vec-
* Département de cardiologie et pathologie
vasculaire, CHU Robert-Debré, Reims.
** Service de cardiologie, hôpital Bouci-
cault, Paris.
*** INSERM U25, faculté de médecine
Necker-Enfants malades, Paris.
185
Le Courrier de l’Arcol (1), n° 4, décembre 1999
Intérêts de la thérapie
génique en pathologie
cardiovasculaire :
principes et exemples d’applications
C. Brasselet*,A. Lafont**, P. Lemarchand***, D. Metz*
L
L

ACTUALITÉ
186
Le Courrier de l’Arcol (1), n° 4, décembre 1999
teurs utilisés (2). Le transfert n’est possible
que si la cellule hôte possède le récepteur
membranaire pour le rétrovirus concerné.
Néanmoins, le rendement de transfert est
faible. Le principal avantage de ces vecteurs
est une expression stable du transgène dans
le temps, après la transfection (plusieurs
mois), du fait de l’intégration génomique.
Les inconvénients de ces vecteurs sont une
instabilité dans le temps, et le fait qu’ils
soient difficiles à concentrer et à purifier. Ils
sont, de plus, associés à un risque de muta-
genèse induite. Ils ne transfectent que les
cellules en phase de division, et ne s’appli-
quent pas à la transfection directe in vivo.
Ils sont testés dans des protocoles de théra-
pie génique pour des transfections ex vivo,
avant transplantation cellulaire. Dans la
famille des rétrovirus, les lentivirus déve-
loppés à partir du VIH permettent un trans-
fert stable du gène dans des cellules qui ne
sont pas en phase de division. Ces nouveaux
vecteurs sont en cours d’évaluation (1-3).
Les vecteurs adénoviraux pénètrent par
endocytose après liaison avec un récepteur
membranaire. L’ADN double brin est libéré
dans le cytoplasme, puis transporté vers le
noyau cellulaire où il se situe en position épi-
somale (c’est-à-dire, non intégré à l’ADN cel-
lulaire). La transcription virale est sous le
double contrôle des facteurs de transcription
cellulaire et de l’expression de la région E1
du vecteur adénoviral. Pour les applications
de thérapie génique, les adénovirus sont ren-
dus déficients pour la réplication par la délé-
tion de leur région E1. Les avantages liés à
ces vecteurs sont la possibilité d’infection de
cellules en phase quiescente, la production
relativement aisée de stocks importants de
vecteurs, la transfection efficace des cellules-
cibles par instillation locale, et la limitation
des risques de mutagenèse du fait de la situa-
tion épisomale du transgène. Le rendement de
la transfection est élevé. L’expression du
transgène est relativement limitée dans le
temps, mais cette expression transitoire n’est
pas un obstacle dans certaines situations
(resténose après angioplastie), et confère
même une certaine sécurité au traitement.
Outre le caractère transitoire de l’expression
du transgène, les inconvénients des vecteurs
adénoviraux sont l’induction d’une réponse
immune qui aboutit à la destruction des cel-
lules transfectées par le vecteur adénoviral, et
le risque de réplication des vecteurs adénovi-
raux lors de l’emploi de hauts titres de trans-
fections. D’autres vecteurs adénoviraux, dits
de “deuxième génération”, permettent une
expression plus importante du transgène,
et donc une production protéique plus impor-
tante, tout en s’accompagnant d’une modé-
ration de la réponse immune cellulaire (1-3).
D’autres vecteurs viraux (essentiellement
les adeno-associated viruses [AAV]) sont
en cours d’évaluation.
Vecteurs non viraux
Même si les systèmes vectoriaux viraux
sont très efficaces, deux éléments suggèrent
que les systèmes non viraux pourraient être
préférables dans l’avenir : la sécurité d’em-
ploi et la facilité de fabrication (1). Dans ces
constructions, l’ADN est complexé ou
conjugué à des molécules facilitant la péné-
tration intracellulaire. Le principal avantage
de ces vecteurs est de pouvoir se passer de
l’usage d’agents infectieux.
Les liposomes sont des vésicules lipidiques,
artificiellement chargées positivement, qui
incorporent l’ADN plasmidique chargé, lui,
négativement. Ces complexes d’ADN et de
lipides cationiques sont internalisés dans les
cellules-cibles par endocytose. La principale
limite de ces vecteurs est la destruction de la
majeure partie de l’ADN par les lysosomes
cytosoliques. Seuls 1 à 2 % de l’ADN conte-
nus dans le vecteur parviennent effective-
ment au noyau. Cet ADN transfecté se situe
en position épisomale (2, 3).
Les plasmides ont aussi un faible rende-
ment de transfert (3).
L’efficacité des liposomes peut être optimisée
par l’hemagglutinating virus of Japan (HVJ),
inactivé par la chaleur. Les HVJ-liposomes
n’ont pas de toxicité connue, et sont dix fois
plus efficaces que les liposomes seuls pour
transfecter les cellules-cibles (2, 3).
Ces trois constructions non virales ont deux
inconvénients majeurs. L’efficacité et le ren-
dement de transfection in vivo sont beaucoup
plus faibles que ceux des vecteurs viraux. Ce
rendement varie avec le statut des cellules
transfectées (quiescentes ou en division). Ces
trois constructions non virales n’autorisent
qu’une expression transitoire du transgène
(quelques jours), mais ne sont cependant pas
à l’origine d’effet indésirable majeur. Leur
situation reste épisomale, comme les vec-
teurs adénoviraux (1-3). Leur production est
aisée et sans risque (4).
Actuellement, de nombreux travaux sont en
cours soit pour optimiser les constructions
déjà existantes (adénovirus de deuxième
génération), soit pour développer de nou-
veaux vecteurs (vecteurs conjugués) (3).
Exemples d’application
En pathologie cardiovasculaire, la thérapie
génique s’adresse non seulement aux mala-
dies constitutionnelles, mais aussi aux
pathologies acquises.
La première étude clinique utilisant la tech-
nique du transfert de gène a été menée par
l’université du Michigan (États-Unis). Elle
consistait en la transfection ex vivo de
cellules hépatiques par un vecteur rétroviral
permettant la surexpression du gène LDL
human receptor. Les patients inclus dans
l’étude présentaient une hypercholestéro-
lémie et une maladie athéroscléreuse
prématurée, en rapport avec un déficit en
LDL-récepteurs. Après une greffe hépatique
de cellules transfectées, les taux de LDL
plasmatiques ont baissé de façon signifi-
Vecteurs Rendement de Intégration Stabilité Inconvénients
transfection génomique majeurs
Viraux rétroviraux faible oui mois mutagenèse
adénoviraux élevé non semaine inflammation
immunogénicité
Non viraux liposomes faible non jours non
plasmides faible non jours non
HVJ-liposomes faible non jours non
Tableau I. Différents vecteurs de thérapie génique.

187
Le Courrier de l’Arcol (1), n° 4, décembre 1999
cative. Parallèlement, les taux de HDL plas-
matiques augmentaient (9).
D’autres anomalies génétiques, comme cer-
tains déficits de facteurs de la coagulation
(déficits en facteurs VIII et IX), peuvent
bénéficier de ce mode thérapeutique (2).
Seule la durée limitée d’expression du
transgène conditionne la réussite et la faisa-
bilité pratique de ce traitement.
À côté des maladies constitutionnelles, la
thérapie génique peut s’appliquer à la lutte
contre le développement ou la progression
de pathologies acquises. Or, du fait du
caractère multifactoriel de ces maladies,
leur prise en charge est beaucoup plus déli-
cate, et représente un défi bien plus difficile
à relever que le “simple” remplacement
d’un gène déficitaire.
La resténose après angioplastie concerne
35 % des 70 000 angioplasties annuelles
réalisées en France. Elle est fréquente, coû-
teuse, réfractaire aux thérapies classiques,
et du fait des améliorations techniques
actuelles, la thérapie locale est désormais
possible. Plusieurs phases successives
concourent au phénomène de resténose
après angioplastie. Durant les premières
heures, les processus inflammatoires et
thrombotiques dominent. Ensuite, durant
sept jours, l’activité de prolifération des
cellules musculaires lisses est majeure.
Enfin, la production de matrice extracellu-
laire clôt ce processus complexe. Cette cas-
cade d’enchaînements complexes est
modulée et contrôlée par de nombreux fac-
teurs, sur lesquels les produits des vecteurs
de thérapie génique peuvent agir. La cible
initiale de la lutte contre la resténose était
l’inhibition de la prolifération des cellules
musculaires lisses. Aujourd’hui, le remode-
lage vasculaire apparaît comme le principal
mécanisme responsable de la resténose (5).
Les différents mécanismes contrôlant le
remodelage ne sont pas encore parfaite-
ment connus. Les cibles, et donc les gènes
d’intérêt à surexprimer sont encore à défi-
nir. De nombreuses stratégies ont été tes-
tées avec des résultats expérimentaux
encourageants :
–Oligonucléotides antisens : c-myb, cdk2,
proliferating cell nuclear antigen ;
– Gènes suicides : thymidine kinase, cyto-
sine désamisase ;
– Gènes contrôlant la prolifération cellu-
laire : gène gax,retinoblastoma gene,pro-
téine p21, protéine p53 ;
–Cytokines et médiateurs cellulaires :
NO, fibroblast growth factor,vascular
endothelial growth factor (VEGF), cyclo-
oxygénase, agents antithrombotiques ;
–Anticorps : anti-TGF (transforming
growth factor) (1, 2, 4-6).
Le développement de l’athérosclérose
débute au cours de la seconde décennie.
Actuellement, il n’est pas possible de savoir
si la thérapie génique sera efficace ou réali-
sable dans la prévention primaire des
lésions d’athérosclérose. Cependant, elle
constitue probablement une stratégie de sta-
bilisation des plaques vulnérables (inhibi-
tion des métalloprotéinases, prévention de
la formation du thrombus), comme de limi-
tation de la progression de ces plaques
(inhibition de la prolifération ou de la
migration cellulaire, actions antioxydatives,
blocage des cytokines ou des facteurs de
croissance, correction de la dysfonction
endothéliale...) (2, 4).
L’injection de vascular endothelial growth
factor stimule la néo-angiogenèse sur un
modèle porcin d’ischémie myocardique
chronique (11). Le transfert de fibroblast
growth factor 5 améliore le flux sanguin et la
contractilité des segments myocardiques
ischémiques d’après Giordano et coll. (8).
Des études sont en cours, concernant la prise
en charge de cardiopathies ischémiques si-
tuées au-delà de toute possibilité de
revascularisation classique (intervention-
nelle ou chirurgicale), en stimulant la néo-
angiogenèse par la technique du transfert de
gène.
La maladie du greffon veineux est le talon
d’Achille des revascularisations myo-
cardiques chirurgicales. Malgré le dévelop-
pement de nouvelles techniques (artère
mammaire interne, gastro-épiploïque, ra-
diale), les greffons veineux sont encore
largement utilisés. Soumis à un régime
hémodynamique artériel, les greffons subis-
sent une adaptation aboutissant à la forma-
tion du thrombus, à une hyperplasie néo-
intimale et à un remodelage vasculaire.
Baker et coll. rapportent les différentes cibles
potentielles susceptibles de prévenir la mala-
die du greffon par thérapie génique (12).
Isner et coll. montrent l’intérêt du transfert
du gène VEGF par vecteur plasmidique, dans
le cadre des pathologies artérielles périphé-
riques. Ils obtiennent ainsi l’augmentation du
nombre de vaisseaux collatéraux, mais aussi
des vélocités sanguines enregistrées en péri-
phérie chez des patients en stade IV de la
classification de Fontaine et Leriche (13).
Conclusion
Aucun vecteur de thérapie génique ne pos-
sède toutes les qualités d’un vecteur optimal.
Cependant, la diversité des cibles potentielles
rend difficile la standardisation d’un vecteur
qui serait applicable à toutes les situations.
De nombreux problèmes théoriques et pra-
tiques devront encore être résolus avant que
la thérapie génique ne soit employée en cli-
nique courante. De nombreuses études sont
encore nécessaires pour confirmer la sécurité
et l’efficacité de la thérapie génique, dans un
premier temps chez l’animal, puis, à terme,
chez l’homme. Néanmoins, elle représente
un formidable espoir pour de nombreuses
pathologies, en particulier dans le domaine
cardiovasculaire. ■
Références
1. Anderson W.F. Human gene therapy. Nature
1998 ; 382 : 25-30.
2. Glowes A.W. Vascular gene therapy in the 21st
century. Thromb Haemost 1997 ; 78 : 605-10.
3. Feldman L.J., Steg G. Optimal techniques for
arterial gene transfer. Cardiovasc Res 1997 ;
35 (3) : 391-404.
4. Ylä-Herttuala S. Vascular gene transfer. Curr
Opin Lipidol 1997 ; 8 : 72-6.
5. Lafont A., Guerot C., Lemarchand P. Prospect for
gene therapy in cardiovascular disease. Eur Heart J
1996 ; 17 (9) : 1312-7.
6.Nikol S. Possible uses of gene therapy in reducing
coronary restenosis. Heart 1997 ; 78 : 426-8.
7. Gérard R.D. Antithrombotic gene therapy. Fibrin
Prot 1997 ; 11 (suppl. 2) : 171-6.
8. Giordano F.J., Ping P., Mc Kirnan M.D. et coll.
Intracoronary gene transfer of fibroblast growth fac-
tor 5 increases blood flow and contractile function
in an ischemia region of the heart. Nature Medicine
1996 ; 2 : 504-9.
9. Grossman M., Maper S.E., Kozarsky K. et coll.
Successful ex vivo gene therapy directed to liver in a
patient with familial hypercholesterolaemia. Nature
Genet 1994 ; 6 : 335-41.
10. Laitinen M., Mäkinen K., Manninen H. et coll.
Adenovirus mediated gene transfer to lower limb
artery of patients with chronic critical lag ischemia.
Hum Gene Ther 1998 ; 9 : 1481-6.
11. Lopez J.J., Laham R.J., Stamler A. et coll.
VEGF administration in chronic myocardial ische-
mia in pigs. Cardiovasc Res 1998 ; 40 : 272-81.
12. Baker A.H., Mehta D., George S.J. et coll.
Prevention of vein graft failure : potential applica-
tions for gene therapy. Cardiovasc Res 1997 ; 35 :
442-50.
13. Isner J.M., Pieczek A., Schainfeld R. et coll.
Clinical evidence of angiogenesis after arterial gene
transfer of VEGF in patient with ischaemic limb.
1
/
3
100%