Lire l`article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 4 - avril 2010
108
dossier thématique
Hormones
et relations humaines
L’
histoire du lien entre la testostérone et les
comportements sociaux a débuté en 1849,
lorsque le physiologiste et anatomiste
allemand A.A. Berthold constate la régression des
caractères sexuels secondaires et des comportements
sexuel et agressif à la suite de la castration et leur
réapparition après la gree de testicules chez le jeune
coq (1). Mais l’article fondateur des recherches sur
l’inuence hormonale du cerveau et du comporte-
ment a vu le jour en 1959 (2) : Charles Phoenix et ses
collaborateurs proposent alors pour la première fois
que l’exposition du cerveau aux stéroïdes gonadiques
au cours du développement organise de manière per-
manente et irréversible le substrat neural. Ce dernier
est sélectivement activé, plus tard à l’âge adulte, par
ces mêmes hormones pour induire l’expression du
comportement sexuel mâle ou femelle (gure 1). C’est
l’hypothèse de l’eet organisationnel et activationnel
des androgènes, qui a suscité un demi-siècle d’études
passionnantes sur les animaux de laboratoire. Cette
revue résume l’état des connaissances actuelles sur la
relation entre androgènes et comportements animal
et humain.
Androgènes et comportement
sexuel animal
La testostérone orchestre la mise en place
du comportement sexuel animal
Le comportement sexuel mâle chez le rat et la souris
est induit dès lors qu’une femelle en œstrus, spontané
ou expérimentalement induit, est mise en présence
du mâle. Ce comportement débute par une phase
appétitive ou motivationnelle pendant laquelle le mâle
renie les parties ano-génitales de la femelle, marque
une préférence pour les femelles réceptives, émet des
vocalisations et urine. Ensuite, la phase d’accouple-
ment consiste en des montées, des intromissions et se
termine par l’éjaculation. Ce comportement stéréotypé
chez les rongeurs peut être nement analysé en mesu-
rant plusieurs paramètres. Pour exemple, la latence
de la première montée rend compte de l’état de moti-
vation du mâle, alors que la durée d’accouplement
depuis la première intromission jusqu’à l’éjaculation
ou encore le nombre d’intromissions renseignent sur
la performance du mâle.
La femelle, en revanche, adopte une posture de lor-
dose favorable à l’accouplement uniquement pendant
la période de l’œstrus, à la suite d’une imprégnation
séquentielle en œstradiol et en progestérone.
Androgènes et comportements sociaux :
de la gonade au cerveau
Androgens and social behaviors: from gonad to brain
Sakina Mhaouty-Kodja, Kalina Raskin*
* Laboratoire de physio-
pathologie des maladies
du système nerveux
central, UMR CNRS 7224,
université Pierre-et-Marie-
Curie, Paris.
»
Au cours de la période pré- et/ou néonatale, la testostérone
gonadique influence de manière permanente l’organisation des
structures cérébrales et spinales impliquées dans l’expression du
comportement sexuel.
»
La testostérone sculpte les structures nerveuses, notamment en
agissant sur le nombre des neurones et sur leur morphologie.
»
À l’âge adulte, la testostérone chez le mâle et l’œstradiol/
progestérone chez la femelle activent les circuits neuronaux mis en
place pendant la période périnatale, pour induire le comportement
sexuel.
»
Les mécanismes mis en jeu par la testostérone impliquent non
seulement les récepteurs des œstrogènes, décrits jusqu’à présent
comme la voie de signalisation majeure de la testostérone, mais
également le récepteur des androgènes.
»
La régulation des comportements agressifs est complexe et
semble impliquer plusieurs facteurs qui agissent de concert avec la
testostérone ou indépendamment de celle-ci.
Mots-clés : Testostérone – Système nerveux – Comportement sexuel –
Comportement agressif – Récepteurs des œstrogènes et des androgènes.
Keywords: Testosterone – Nervous system – Sexual behavior – Aggression –
Estrogen and androgen receptors.
Points forts

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 4 - avril 2010
109
Androgènes et comportements sociaux : de la gonade au cerveau
Activité gonadique et sensibilité du système
nerveux pendant la période périnatale
Chez le mâle, les testicules se développent pendant
la vie fœtale, en réponse à une cascade moléculaire
initiée par le gène Sry (Sex determination factor) situé
sur le chromosome Y. La production d’androgènes,
de testostérone et de 5-α-dihydrotestostérone (DHT)
par les testicules est nécessaire à la diérenciation
sexuelle des organes génitaux. La libération de tes-
tostérone atteint un pic en n de gestation et juste
après la naissance qui coïncide avec la période cri-
tique de sensibilité du système nerveux central aux
androgènes. C’est à cette période que la testostérone
organise de manière permanente et irréversible les
circuits neuronaux, en activant les processus de mas-
culinisation et de déféminisation. La masculinisation
a pour but de renforcer l’expression des fonctions et
des comportements typiques des mâles à l’âge adulte,
alors que la déféminisation consiste à supprimer les
caractéristiques femelles (gure 2, p. 110). Les niveaux
de testostérone diminuent par la suite et n’augmentent
qu’à la puberté, après la réactivation de l’axe hypotha-
lamo-hypophysaire gonadotrope (HPG).
Chez la femelle, la diérenciation des ovaires a lieu en
l’absence de testostérone. Pendant toute la période
prénatale, les ovaires fœtaux sont inactifs et le cer-
veau femelle est protégé de l’eet masculinisant des
stéroïdes sexuels environnants grâce à la présence de
l’α-fœtoprotéine (3). Les mécanismes à l’origine de la
féminisation du cerveau femelle sont encore méconnus.
L’idée qui prédomine actuellement est que la fémini-
sation des structures cérébrales se ferait par défaut, à
l’instar de la diérenciation sexuelle des ovaires.
Organisation périnatale de la fonction neuro-
endocrine et de la réponse comportementale
Axe HPG
La synthèse de testostérone dans le testicule et d’œs-
tradiol dans l’ovaire est sous le contrôle de la GnRH
hypothalamique et des gonadotrophines hypophy-
saires (Luteinizing Hormone [LH] et Follicle-Stimulating
Hormone [FSH]). Les stéroïdes sexuels contrôlent,
en retour, la libération des gonadotrophines. Cette
rétroaction peut être de nature inhibitrice ou activa-
trice. Mâles et femelles répondent au rétrocontrôle
inhibiteur, mais seules les femelles répondent au rétro-
contrôle positif. Ce dernier est important dans l’induc-
tion de la décharge de GnRH et de LH nécessaire au
déclenchement de l’ovulation et de la réceptivité chez
la femelle. La perte de ce rétrocontrôle positif chez
les mâles est un bon exemple de déféminisation des
circuits neuronaux qui gouvernent la neurosécrétion
de la GnRH. Le noyau antéroventral périventriculaire
(AVPV) de la région préoptique hypothalamique joue
un rôle critique dans l’intégration du signal positif de
l’œstradiol. Il contient une des deux populations de
neurones à Kiss1, l’autre étant localisée dans le noyau
arqué, qui envoie des projections vers les neurones à
GnRH et régule leur activité. Le nombre de ces neu-
rones est plus important chez la femelle (4).
Circuit neuronal du comportement sexuel
Chez les rongeurs, le comportement sexuel est induit
par les phéromones sécrétées par le partenaire. Les
phéromones détectées par l’organe voméronasal et
l’épithélium olfactif stimulent les bulbes olfactifs prin-
cipal et accessoire, qui activent à leur tour l’amygdale
médiane, le noyau du lit de la strie terminale (NLST) et,
enn, la région préoptique localisée dans l’hypotha-
lamus. Des dimorphismes sexuels anatomiques ont
été décrits tout au long de ce circuit neuronal. Pour ne
citer que la région préoptique, siège de l’expression
du comportement sexuel mâle, plusieurs diérences
anatomiques ont été décrites entre mâle et femelle.
La diérence sexuelle la plus spectaculaire concerne
un noyau appelé “noyau sexuellement dimorphique”
chez le rat. Il est plus large chez le mâle en raison d’un
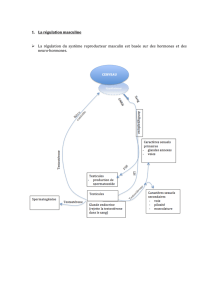
Figure 1. Expérience démontrant l’eet de l’imprégnation de testostérone pendant la période néonatale
sur l’expression du comportement sexuel chez le rat adulte.
A. La gonadectomie de nouveau-nés mâles diminue l’expression du comportement sexuel mâle et induit
un comportement femelle (posture de lordose) lorsque ces animaux reçoivent de l’œstradiol (E2) et de la
progestérone (P) à l’âge adulte.
B. À l’inverse, l’injection de testostérone à des femelles diminue le comportement de lordose et augmente
la capacité à monter des femelles réceptives lorsqu’elles reçoivent de la testostérone (T) à l’âge adulte.
Période néonatale
A
B
Testostérone
Âge adulte
Altération du comportement mâle
Induction de la lordose (E2 + P)
Suppression de la lordose
Montée de femelles réceptives (T)

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 4 - avril 2010
110
dossier thématique
Hormones
et relations humaines
nombre de neurones plus élevé (5). La région préop-
tique contient également une densité importante en
épines dendritiques chez le mâle (6), ce qui témoigne
probablement d’une plus grande plasticité synaptique.
Au niveau spinal, le noyau du nerf bulbo-caverneux,
situé dans la corne ventrale de la moelle épinière
lombaire, contient des motoneurones qui innervent
les muscles périnéaux impliqués dans l’érection et
l’éjaculation. Chez le mâle, le nombre et la taille de
ces motoneurones sont plus importants que chez
la femelle.
Bien que les mécanismes d’action de la testostérone
ne soient pas complètement élucidés, il semble que
cette hormone utilise divers processus pour organiser
ses circuits neuronaux. Par exemple, elle s’oppose à
la dégénérescence des motoneurones dans le noyau
spinal du nerf bulbo-caverneux (7) alors qu’elle induit
l’apoptose dans l’AVPV (8).
Androgènes et comportement sexuel
humain
La littérature clinique suggère que les hormones gona-
diques joueraient également un rôle fondamental dans
la diérenciation sexuelle du cerveau humain pendant
le développement fœtal. Les testicules et les ovaires se
développent en eet dès la 6
e
semaine de grossesse.
Entre la 6e et la 12e semaine, la production de testos-
térone et de DHT par les testicules est nécessaire à la
diérenciation sexuelle des organes génitaux. Ensuite,
la libération de testostérone atteint un premier pic
entre la 12
e
et la 18
e
semaine de gestation, puis un
deuxième pic prend place pendant les trois premiers
mois de vie postnatale.
C’est pendant la seconde moitié de la gestation que
la testostérone programmerait notre identité du
genre (sexe masculin ou féminin) et notre orientation
sexuelle (hétéro-, homo- ou bisexualité). Le degré de
masculinisation du tractus génital ne reète donc
pas forcément le même degré de masculinisation du
cerveau, puisque ces deux processus ont lieu à deux
périodes diérentes. C’est le cas des patients atteints
d’extrophie cloacale congénitale, avec un développe-
ment très décient du pénis, mais avec une sécrétion in
utero normale d’androgènes. Assignés d’une identité
de genre femelle à la naissance, nombreux sont ceux
qui changent ainsi d’identité à l’adolescence (9).
Le décit en 5α-réductase-2, enzyme qui catalyse la
conversion de testostérone en DHT, altère la diéren-
ciation des organes génitaux mâles externes, mais ne
semble pas aecter le cerveau, puisque les testicules
sont fonctionnels. Cela entraîne un pseudo-herma-
phrodisme caractérisé par la présence d’organes géni-
taux externes femelles chez les individus de génotype
46, XY. Élevés en lles depuis leur naissance, les deux
tiers des patients optent pour une réassignation de
l’identité du genre à la puberté (10). À l’inverse, un
comportement mâle élevé a été observé chez les
femmes présentant un syndrome d’hyperplasie sur-
rénalienne congénitale (11). Cette maladie génétique
due à la décience en 21-hydroxylase, enzyme qui
catalyse la synthèse de corticoïdes dans les glandes
surrénales, est responsable d’une diminution très
importante de la sécrétion d’aldostérone et de corti-
sol, mais entraîne une surproduction d’androgènes
pendant la vie fœtale.
Figure 2.
A. La diérenciation sexuelle des gonades précède celle du cerveau.
B. Chez les mâles, à la suite d’une imprégnation testostéronique pendant la période périnatale, les structures
nerveuses impliquées dans l’expression du comportement sexuel sont masculinisées et déféminisées de
manière irréversible. La féminisation du cerveau femelle semble se produire de manière constitutive, en
l’absence de toute inuence hormonale.
C. À la puberté, après la réactivation de l’axe hypothalamo-hypophysaire-gonadotrope, la testostérone active
le comportement sexuel mâle alors que l’œstradiol (E2) et la progestérone (P) induisent la posture de lordose
pendant l’œstrus.
Mâle Femelle
Période périnatale
Âge adulte
AXY
E2 + P
LordoseMontées
Testicule
Œstradiol
Testostérone
Masculinisation/déféminisation
Ovaire
Féminisation
XX
B
C

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 4 - avril 2010
111
Androgènes et comportements sociaux : de la gonade au cerveau
Des diérences dans la structure et la fonction du
cerveau humain en relation avec l’orientation sexuelle
ont été également observées. S. Levay et al. (12) ont
ainsi rapporté que le noyau interstitiel de l’hypothala-
mus antérieur (INAH-3) était plus petit chez l’homme
homosexuel ou chez la femme hétérosexuelle que
chez l’homme hétérosexuel. Le NLST des transsexuels
mâle-femelle montre un prol femelle plus petit que
chez l’homme, alors que celui des transsexuels femelle-
mâle suit un prol mâle (13). Le transsexualisme est
un trouble de l’identité du genre caractérisé par une
inadéquation entre le sexe biologique et l’identité
sexuelle ressentie. Ces résultats suggèrent l’implication
du INAH-3 dans l’orientation sexuelle et du NLST dans
l’identité du genre.
Mécanismes d’action de la testostérone
et modèles génétiques d’étude
Dans le système nerveux, la testostérone agit directe-
ment ou par l’intermédiaire de ses métabolites DHT et
œstradiol. La testostérone et la DHT activent le récep-
teur des androgènes (AR) alors que l’œstradiol stimule
les récepteurs des œstrogènes ERα et ERβ (gure 3).
Les récepteurs AR et ER appartiennent à la superfamille
des récepteurs nucléaires des hormones stéroïdes et
régulent la transcription de gènes cibles. Chez la sou-
ris, les études de délétion ubiquitaire d’un gène dans
l’organisme entier montrent que les mâles invalidés
pour le gène codant le récepteur ERα présentent une
décience du comportement sexuel et de la reconnais-
sance sociale (14). Les souris portant une délétion du
gène codant le récepteur ERβ ont un comportement
sexuel mâle normal. Ces individus sont capables, en
revanche, d’adopter une posture de lordose lorsqu’ils
sont gonadectomisés et imprégnés d’œstradiol et de
progestérone (15). Ces résultats suggèrent que les
processus de masculinisation et de déféminisation
empruntent des voies de signalisation diérentes.
L’implication de l’AR est restée jusque-là controversée
en raison du rôle critique de ce récepteur dans la dif-
férenciation sexuelle du tractus génital mâle. En eet,
chez la souris, la délétion de l’AR dans l’organisme
entier résulte en un phénotype femelle avec un trac-
tus génital indiérencié et des taux de testostérone
très bas chez les individus de génotype XY (16). Des
mutations similaires existent dans la nature aussi bien
chez les rongeurs (testicular feminization mutation) que
chez l’homme (syndrome d’insensibilité totale aux
androgènes). Une acceptation uniforme de l’identité
femelle concerne les patients 46, XY atteints de ce
Figure 3. Mécanismes d’action de la testostérone dans le circuit neuronal impliqué dans l’expression du
comportement sexuel mâle.
La testostérone (T) peut agir directement ou via son métabolite, la 5-α-dihydrotestostérone (DHT), après
conversion par la 5-α-réductase. La testostérone peut être également métabolisée in situ en œstradiol
(E2) par le cytochrome P450 aromatase. Testostérone et DHT activent le récepteur des androgènes (AR)
alors que l’E2 stimule les récepteurs des œstrogènes ERα et ERβ. Ces trois récepteurs activent ou répriment
la transcription de gènes cibles.
DHT
T
AR
ER ER AR
Aromatase 5α-réductase
Gènes cibles
Figure 4. Comparaison phénotypique des animaux entre le modèle d’invalidation ubiquitaire et le modèle
d’invalidation conditionnelle dans le système nerveux du gène codant le récepteur des androgènes (AR).
Invalidation du récepteur des androgènes
Invalidation ubiquitaire Invalidation conditionnelle
Système nerveux Système nerveux
Tissus périphériques Tissus périphériques
Absence de pénis, ouverture vaginale
Testicules atrophiés azoospermiques
Absence de canal déférent, d’épididyme,
de vésicules séminales et de prostate
Niveaux circulants de testostérone bas
Formation du pénis
Testicules et tractus uro-génital
normalement développés
Niveaux circulants de testostérone élevés
Phénotype
des individus XY Expression de l’AR
Femelle Mâle

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIV - n° 4 - avril 2010
112
dossier thématique
Hormones
et relations humaines
syndrome. Néanmoins, chez la souris, il est très dicile
de savoir si ce phénotype est dû à l’absence de l’AR ou
aux faibles taux circulants de testostérone.
An d’évaluer précisément le rôle de l’AR dans la régu-
lation du comportement sexuel, nous avons généré
une lignée de souris pour lesquelles le gène codant
ce récepteur a été invalidé uniquement dans le sys-
tème nerveux (gure 4, p. 111). La caractérisation des
souris portant cette délétion montre l’absence de la
protéine AR dans l’ensemble des régions cérébrales
et notamment dans le circuit neuronal impliqué dans
l’expression du comportement sexuel. L’expression
périphérique de l’AR n’est pas aectée, comme l’atteste
la présence de ce récepteur dans les cellules gonado-
tropes hypophysaires et dans les testicules (17). Les
individus de génotype XY dépourvus d’AR dans le sys-
tème nerveux sont de phénotype mâle et ont un trac-
tus génital normalement développé. L’analyse de leur
statut hormonal indique des niveaux de testostérone
et de LH très élevés, ce qui témoigne de l’implication
de l’AR dans le rétrocontrôle inhibiteur exercé par la
testostérone chez le mâle. Malgré des taux élevés de
testostérone, ils présentent une altération de la motiva-
tion et de la performance sexuelles (17). La préférence
normale des mâles mutants pour des odeurs issues de
femelles réceptives indique que l’altération du com-
portement sexuel se situe en aval du bulbe olfactif.
Il apparaît donc que la testostérone active plusieurs
types de récepteurs (ERα, ERβ et AR) pour réguler
l’expression du comportement sexuel mâle chez la
souris. Chez l’homme, c’est l’AR qui semble jouer un
rôle prépondérant, puisque la décience en aromatase
ou en ERα n’aecte ni l’identité du genre ni l’orienta-
tion sexuelle (18).
L’inuence précoce des hormones sexuelles sur le cer-
veau et sur le comportement sexuel humain est d’ac-
tualité. Nous sommes loin du concept de la neutralité
sexuelle à la naissance, défendu dans les années 1950.
Néanmoins, il reste encore des voies à explorer dans
ce domaine et plus particulièrement celle des méca-
nismes d’action de la testostérone. La très grande
complexité de ces mécanismes est bien illustrée par
le fait qu’aucun des neurotransmetteurs (dopamine,
sérotonine, noradrénaline, acétylcholine) mis en cause
dans l’expression du comportement sexuel n’a été
capable à lui seul de le restaurer chez l’animal gona-
dectomisé. Il est donc important d’identier la nature
des voies de signalisation activées par les récepteurs
AR et/ou ER, et par conséquent leurs gènes cibles,
dans l’organisation et l’activation des circuits neuro-
naux impliqués dans l’expression du comportement
sexuel. Les modèles animaux d’invalidation de gènes
restreinte au système nerveux entier ou à certaines
populations neuronales orent une bonne opportu-
nité de relever ce dé, même si une grande prudence
doit être de mise dans l’extrapolation des résultats de
la souris à l’homme.
Testostérone et agressivité
L’agression est un comportement déni par l’intention
d’iniger des dommages physiques à autrui. Elle est
déclenchée par une multitude de conditions sociales
ou de facteurs environnementaux. On distingue ainsi
l’agression contrôlée ou oensive (prédation, terri-
torialité) et l’agression réactive ou défensive (induite
par la peur, l’irritabilité…). Les études, initiées sur le
jeune coq et étendues par la suite à d’autres espèces
dont les rongeurs, sont en faveur du rôle de la tes-
tostérone dans les comportements mâles d’agression
de congénères. La délétion des gènes codant pour
l’ERα et l’AR altère ce comportement chez la souris
(14, 17). Cependant, chez les animaux à reproduction
saisonnière, on observe aussi des comportements
agressifs en dehors de la saison de reproduction alors
que les niveaux de testostérone sont très bas (19).
Les statistiques issues d’études criminologiques
indiquent que les hommes sont davantage impli-
qués dans des délits et des crimes d’agression que
les femmes. Néanmoins, alors que des recherches
suggèrent une corrélation positive entre testostérone
et agression (20), d’autres concluent au contraire à
une très faible association (21). Un article très récent
montre même que l’administration préalable d’une
dose de testostérone à des femmes réduit les conits
et augmente l’ecacité d’interactions sociales dans
le jeu de la négociation sous ultimatum (22). Le lien
entre testostérone et agression est donc loin d’être
aussi évident que pour le comportement sexuel. L’idée
émergente est que le contrôle du comportement
agressif chez l’animal et chez l’homme impliquerait
une myriade de régulateurs (déhydroépiandrostérone,
glucocorticoïdes, vasopressine, sérotonine, mélato-
nine…) agissant de concert avec la testostérone ou
indépendamment de celle-ci. Des travaux menés chez
les rongeurs et les primates montrent que l’altération
de certains de ces systèmes par des traumatismes
subis pendant le jeune âge induit une agressivité
exacerbée ou inappropriée à l’âge adulte (23). Le dé
des prochaines années est de dénir la nature des
mécanismes neuroendocrines, neurobiologiques et
épigénétiques impliqués dans chaque type de com-
portement agressif.
■
 6
6
1
/
6
100%