LA CLASSIFICATION PERIODIQUE DES ELEMENTS

LA CLASSIFICATION PERIODIQUE DES ELEMENTS
Comment a été établie la classification périodique des éléments
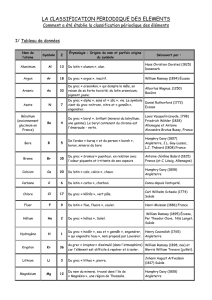
I/ Tableau de données
Nom de
l’atome
Symbole
Z
Étymologie : Origine du nom et parfois origine
du symbole
Découvert par :
Aluminium
Al
13
Du latin « alumen », alun.
Hans Christian Oersted (1825)
Danemark
Argon
Ar
18
Du grec « argos », inactif.
William Ramsay (1894) Écosse
Arsenic
As
33
Du grec «
arsenikon
, » qui dompte le mâle, en
raison de sa forte toxicité; du latin
arsenicum
,
pigment jaune;
Albertus Magnus, (1250)
Bavière
Azote
N
7
Du grec « alpha », sans et « zôc », vie. Le symbole
vient du grec «nitron», nitre et « gennân »,
engendrer.
Daniel Rutherford (1772)
Ecosse
Béryllium
(anciennement
glucinium en
France)
Be
4
Du grec « beryl », brillant (minerai du béryllium,
une gemme). Le beryl contenant du chrome est
l'émeraude - verte.
Louis Vauquelin (oxyde, 1798)
Friedrich Wöhler (1828)
Allemagne et Antoine
Alexandre Brutus Bussy, France
Bore
B
5
De l’arabe « buraq » et du persan « burah »,
borax, minerai du bore
Humphry Davy (1807)
Angleterre, J.L. Gay-Lussac,
L.J. Thénard (1808) France
Brome
Br
35
Du grec «
bromos
» puanteur, en relation avec
l'odeur piquante et irritante de ses vapeurs
Antoine-Jérôme Balard (1825)
France (et C. Löwig, Allemagne)
Calcium
Ca
20
Du latin « calx, calcis », chaux.
Humphry Davy (1808)
Angleterre
Carbone
C
6
Du latin « carbo », charbon.
Connu depuis l’antiquité.
Chlore
Cl
17
Du grec « klôrôs », vert pâle.
Carl Wilhelm Scheele (1774)
Suède
Fluor
F
9
Du latin « fluo, fluere », couler.
Henri Moissan (1886) France
Hélium
He
2
Du grec « hélios », Soleil.
William Ramsay (1895) Écosse,
Per Theodor Cleve, Nils Langet,
Suède
Hydrogène
H
1
Du grec « hedôr », eau et « gennâh », engendrer,
« qui engendre l’eau », nom proposé par Lavoisier.
Henry Cavendish (1765)
Angleterre
Krypton
Kr
36
du grec «
kruptos
» dissimulé (dans l'atmosphère)
car l'élément est difficile à repérer et à isoler.
William Ramsay (1898, mai) et
Morris William Travers (juillet).
Lithium
Li
3
Du grec « lithos », pierre.
Johann August Arfvedson
(1817) Suède
Magnésium
Mg
12
Du nom du minerai, trouvé dans l'ile de
« Magnésia », une région de Thessalie.
Humphry Davy (1808)
Angleterre

Néon
Ne
10
Du grec « néos », nouveau.
William Ramsay, Morris
WilliamTravers (1898)
Angleterre
Oxygène
O
8
Du grec « oxus », acide et « gennân », engendrer,
« qui engendre les acides », nom proposé par
Lavoisier.
Joseph Priestley (1774)
Angleterre, Carl Wilhelm
Scheele (1773, publié en 1777)
Suède
Phosphore
P
15
Du grec « phos », lumière et « phoros », qui
porte, « qui porte la lumière ».
Hennig Brand (1669) Allemagne
Potassium
K
19
De l’anglais « potash », potasse (cendre de pot).
Le symbole vient de l'arabe « kali », devenu en
latin « kalium ».
Humphry Davy (1807)
Angleterre
Silicium
Si
14
Du latin « silex, silicis », roche siliceuse très
dure.
Jöns Jacob Berzelius (1823)
Suède
Sodium
Na
11
De l’anglais « soda », soude.
Le symbole vient du latin « natrium ».
Humphry Davy (1807)
Angleterre
Soufre
S
16
Du latin « sulphur ».
Connu depuis l’antiquité
II/ A la recherche de Mendeleïev
Dimitri Ivanovich Mendeleïev est né en Sibérie en 1834. C'était le plus jeune d'une famille de 17 enfants.
En 1869, il publia son fameux tableau périodique des éléments. Il rangea les 63 éléments connus à cette époque
par masse atomique croissante, il retrouve à intervalles réguliers, des éléments possédant des propriétés
chimiques similaires. Là où existait un trou dans le tableau, il prédit les propriétés d'un nouvel élément.
Trois de ces éléments, le gallium, le scandium et le germanium furent découverts de son vivant et leurs
propriétés correspondaient à ce qu’il avait prévu, ce qui contribua à assurer sa réputation.
III/ Quelques définitions
Un élément est une substance pure qui ne peut être décomposée en substances plus simples. On le définit aussi
comme l'ensemble des atomes qui possèdent le même nombre de protons dans leur noyau (de même numéro
atomique Z). Le tableau périodique, inspiré par Mendeleïev, en donne la liste complète.
Sur la Terre, il existe 90 éléments naturels, le plus léger étant l'hydrogène et le plus lourd l'uranium. Les autres
éléments ont été fabriqués par les scientifiques.
On utilise les symboles chimiques pour représenter les éléments et leurs atomes, de manière qualitative et
quantitative (numéro atomique, nombre de nasse, masse atomique)
Le symbole commence par l'initiale (en majuscule d'imprimerie) du nom international de l'élément suivi,
éventuellement, d'une deuxième lettre (en minuscule) pour éviter les confusions avec d'autres éléments.
IV/ Questions
A° La démarche de Mendeleïev
1) Comment détermine-t-on le symbole d’un élément chimique ?
2) Les réactions chimiques sont-elles gouvernées par : les protons, les neutrons ou les électrons ?
3) Quelle est la caractéristique électrique d’un atome ?
4) Combien d’éléments Mendeleïev avait-il classé ?
5) Selon quels critères ?
6) Quels sont les atomes, du tableau de données, que Mendeleïev ne pouvait pas connaître au moment de la
publication de sa classification périodique ?
7) Vous disposez d’un jeu de cartes. Chaque carte représente un élément chimique ainsi que des renseignements sur
ses propriétés chimiques.

Réaliser une classification, à l’aide de ce jeu de cartes en utilisant les critères utilisés par Mendeleïev. Pour cela,
placer les cartes sur la table en prenant pour modèle le tableau ci-dessous (il ne doit pas y avoir plus de 8
éléments sur une même ligne). Après avoir classé chaque élément, indiquer, sur le tableau ci-dessous, le nom de
l’élément ainsi classé.
B° La démarche moderne
1) Donner le nom et la définition de Z.
2) Ecrire sur chaque carte le nombre Z et la structure électronique de chaque élément.
3) Réaliser alors une nouvelle classification à l’aide des cartes, prenant pour critère les nombres Z croissants et en
faisant apparaître une périodicité des structures électroniques.
Après avoir classé chaque élément, indiquer sur le tableau ci-dessous, le nom de l’élément ainsi que sa structure
électronique.
4) Comparer avec la classification périodique de Mendeleïev.
5) Quand revient-on à la ligne ? Au bout de combien d’électrons ?
6) Comparer la structure électronique des éléments et leurs propriétés chimiques.
7) Chercher les atomes qui ont leur dernier niveau d’énergie saturé en électrons.
8) Chercher les atomes qui ont 1 électron sur le dernier niveau d’énergie.
9) Chercher les atomes qui ont 7 électrons sur le dernier niveau d’énergie.
10) Chercher les atomes qui ont 8 électrons sur le dernier niveau d’énergie.
11) Quel ion stable peut former l’atome de béryllium ? Justifier la réponse.
12) Même question pour l’atome de magnésium.
13) Indiquer sur le tableau ci dessus, la formule de l’ion stable de l’élément correspondant. Donnée : les ions
fortement chargés sont instables.
1
/
3
100%