Épreuve de Chimie Chimie Premier exercice : Liaisons chimiques (6

Épreuve de Chimie
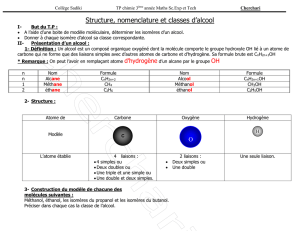
Nom
:
N
o
:
Contrôle
3
,
avril
201
3
Classe : 3
e
Durée : 50 minutes
Chimie
Cette épreuve est constituée de trois exercices.
Elle comporte deux pages numérotées 1/2 et 2/2.
L’usage de la calculatrice n’est pas autorisé.
Premier exercice : Liaisons chimiques (6,5 points)
On considère les éléments suivants : l’azote N (Z = 7), l’hydrogène H (Z = 1) et le sodium Na
(Z = 11).
1. Écrire la configuration électronique de l’atome de chacun des trois éléments.
2. Donner le nom de la famille chimique à laquelle appartient le sodium.
3. Donner la représentation de Lewis de chaque atome et préciser sa valence.
4. L’azote et le sodium établissent entre eux une liaison ionique. Expliquer la liaison chimique
établie. Donner la formule ionique et la formule statistique du composé formé.
5. L’azote se lie à l’hydrogène par une liaison covalente. Écrire la formule structurale de chacune
des molécules suivantes : NH
3
et N
2
H
4
.
Deuxième exercice : Dorure d’un clou en fer (6,5 points)
On désire recouvrir un clou en fer par une mince couche d’or en réalisant une électrolyse. Pour cela,
on dispose du matériel suivant :
- clou en fer ;
- lame de fer ;
- lame d’or ;
- solution concentrée en ions Fe
2+
;
- solution concentrée en ions Au
3+
;
- générateur de tension continue ;
- fils de connexion ;
- électrolyseur.
1. Choisir le matériel nécessaire à la dorure du clou en fer.
2. Faire un schéma annoté du montage réalisé. Indiquer le sens de déplacement des électrons.
3. Nommer le phénomène qui se déroule au niveau de chaque électrode et écrire la demi-équation
électronique correspondante.
1/2

4. Préciser comment varie la concentration des cations métalliques en solution.
5. Donner le nom de ce type d’électrolyse.
Troisième exercice : Hydrocarbures aliphatiques (7 points)
(A) et (B) et (C) sont trois hydrocarbures aliphatiques.
1. (A) est un hydrocarbure aliphatique insaturé possédant dans sa molécule une liaison covalente
double.
a. Trouver la formule moléculaire de (A) si l’atomicité de sa molécule est 9.
b. Écrire sa formule développée et donner son nom.
2. (B) est un alcane. Sa formule semi-développée est la suivante :
CH
3
CH
3
– CH – CH – CH
3
C
2
H
5
a. Donner le nom systématique de (B).
b. Trouver sa formule moléculaire.
c. De quel alcane à chaîne linéaire est-il isomère ? De quel alcane est-il dérivé ? Justifier chaque
réponse.
3. (C) est un alcane ayant 12 atomes d’hydrogène dans sa molécule.
a. Trouver la formule moléculaire de (C).
b. Écrire toutes les formules semi-développées de (C) et donner le nom de chacune d’elles.
BON TRAVAIL !
2/2
1
/
2
100%