30BU04SV: de l`atome à la molécule organique – Examen du 18

30BU04SV: de l'atome à la molécule organique
–
Examen du 28 juin 2016 – 2ème session
Durée 2h - calculatrice et documents interdits
Barème indicatif sur 30 points. Deux pages R/V
Exercice 1 (~20 min, 4,5 pt):
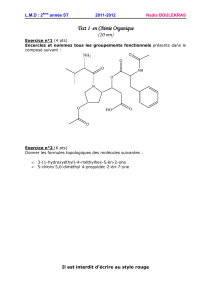
Répondre aux questions suivantes en partant de la formule semi-développée de l’isoleucine:
a) Indiquer explicitement les fonctions présentes dans cette molécule
b) Il y a deux carbones stéréogènes dans l’isoleucine. Distinguer les à l’aide d’un
astérisque.
c) Représenter en projection de Fischer tous les stéréo-isomères et déterminer la
configuration absolue de leurs carbones stéréogènes. Indiquer la relation stéréochimique
entre ces stéréo-isomères (énantiomère ou diastéréoisomère) et leur appartenance à la
série D, ou L.
d) Donner le nom systématique selon IUPAC de l’isoleucine naturelle (L-isoleucine)
sachant qu’elle appartient à la série L et possède deux carbones stéréogènes de
configuration identique.
e) Dessiner la projection de Newman éclipsée la plus stable de la L-isoleucine selon l’axe
C2-C3.
Exercice 2 (~15 min, 4 pts):
Pour chacune des 3 séries suivantes, classer les carbanions par ordre de stabilité
décroissante. Justifier en indiquant les effets électroniques présents, à l’aide des formes
mésomères si besoin est.
Exercice 3 (~25 min, 6,5 pts):
Le (2R,3R)-2-chloro-3-méthylhexane est traité par de l’éthanolate de sodium (EtONa) dans de
l’éthanol et deux groupes d’isomères: (A, A’ et A’’) et (B et B’) sont obtenus. La vitesse des
réactions n’est proportionnelle qu’à la concentration en dérivé chloré pour la formation de ces
produits.
a) Représenter le (2R,3R)-2-chloro-3-méthylhexane en projection de Cram.
COOHH2N

b) Les composés A et A’, de formule brute C7H14, sont largement majoritaires et
optiquement inactifs, tant dis que le composé A’’ est optiquement actif. Quelles sont
leurs structures semi-développées? Par quel mécanisme sont-ils formés? Justifier
votre réponse à l’appui de la vitesse des réactions, des réactifs (composé halogéné et
EtONa) et du solvant. Décrire soigneusement ce mécanisme.
c) Les composés B et B’ sont très minoritaires par rapport à l’autre groupe d’isomères (A,
A’ et A’’), et tous les deux, pris séparément, sont optiquement actifs. Décrire la
structure semi-développée de ces produits en précisant la configuration absolue des
carbones stéréogènes. Par quel mécanisme sont-ils formés ? Décrire soigneusement
ce mécanisme.
d) Comment le ratio des produits (A, A’ et A’’)/(B et B’) varie en fonction de la
température?
Exercice 4, représentations de Lewis et liaisons intermoléculaires (~25
min, 7 pts):
a) Donner la représentation de Lewis des électrons de valence de 6C, H, 9F et 8O.
b) Représenter la molécule CH3FO suivant le modèle de Lewis. Il n'y a pas de liaison O-F.
c) Donner la géométrie de la molécule autour du carbone.
d) On peut synthétiser cette molécule à basse température à partir de formaldéhyde CH2O
et de fluorure d’hydrogène HF. Donner les formules de Lewis pour ces deux molécules.
e) Donner la géométrie du formaldéhyde suivant la VSEPR.
f) Après discussion sur les électronégativités des atomes, indiquer si le formaldehyde
possède un moment dipolaire et le dessiner
g) Quels types d’interactions ont lieu entre les molécules lorsque le formaldéhyde pur se
trouve à l'état liquide? Même question pour le fluorure d’hydrogène pur.
Exercice 5, le bore (~20 min, 5 pts):
Le Bore est présent dans la nature sous la forme de 2 isotopes 10B et 11B. Le numéro
atomique du bore est Z= 5.
a) Donner la composition des atomes de bore correspondant à ses deux isotopes
b) Les abondances naturelles de ces isotopes sont respectivement de 20% et 80%.
Déterminer la masse molaire élémentaire du bore naturel à 1% près.
c) Donner la configuration électronique du bore en distinguant les électrons de valence et
le placer dans le tableau périodique (dont on dessinera les contours).
d) Dessiner un diagramme des orbitales moléculaires de la molécule BH. L'énergie des
orbitales de valence du bore est d'environ -20 eV pour la s et -10 eV pour les p.
Justifier la ou les combinaisons des orbitales atomiques effectuées.
Exercice 6, spectre de l'atome d'hydrogène (~15 min, 3 pts):
On considère un atome d’hydrogène dans un état excité (état 1) où l’électron occupe une
orbitale 3p puis un autre état excité (état 2) où l’électron occupe l’orbitale 2s.
a) Indiquer les valeurs des 3 nombres quantiques n, l et m correspondant aux états
quantiques possibles pour chacun de ces états excités.
b) Représenter schématiquement la forme de chacune de ces orbitales.
c) Donner l'expression de la longueur d'onde du photon émis lorsque cet atome passe de
l’état 1 à l’état 2
Donnée: Pour l'hydrogène, E°= -13.6 eV
1
/
2
100%