TP La formulation et composition d`un médicament élève bis

Thème : La santé sous-thème : Les médicaments TP Formulation et composition d’un médicament
1
Objectifs
: Comprendre qu'un médicament est un mélange – acquérir le vocabulaire spécifique et
comparer les formulations de médicaments.
L'aspirine®, utilisée depuis plus d’un siècle, est le médicament le plus vendu au monde. Pour un coût
fort modeste et sans risque d’accoutumance, l’aspirine® soulage la fièvre et les douleurs associées à
de très nombreuses pathologies ; elle combat efficacement les réactions inflammatoires aiguës.
I- Excipients
1- Exploitation des documents
Quelles sont les deux catégories d'espèces chimiques présentes dans un médicament ?
Identifier le principe actif sur les étiquettes de médicaments proposées. Est-il le même pour
tous les médicaments proposés ?
Identifier quelques types d'excipients et préciser leur rôle.
Les médicaments proposés appartiennent-ils à la même classe thérapeutique ?
2- Mise en évidence d’un composant de l'excipients
a- Expérience n°1
Test préliminaire : Déposer un peu d’amidon dans une coupelle. Ajouter une goutte d’eau iodée
Application à un comprimé d’aspirine : broyer 1/2 comprimé d'Aspirine du Rhône 500® dans un
mortier.
Pour séparer le principe actif de l’excipient, on procède de la façon suivante :
Dissoudre le comprimé réduit en poudre dans environ 5 mL d'éthanol contenu dans un bécher
Filtrer.
Ajouter une goutte d’eau iodée sur le solide recueilli dans le filtre ainsi que dans le filtrat.
Quelle est la substance identifiée dans l’excipient ?
Thème
:
La santé
TP
Formulation et composition d’un médicament
Sous thème
: Les médicaments

Thème : La santé sous-thème : Les médicaments TP Formulation et composition d’un médicament
2
b- Expérience n°2
Expérience préliminaire : Verser un peu d'eau de chaux dans un tube à essai. Souffler
doucement dans l'eau de chaux par l'intermédiaire d'une paille.
Quel est le gaz mis en évidence ?
Préparer de nouveau un tube à essai contenant de l'eau de chaux. Placer un échantillon
d'aspirine UPSA® effervescent dans un 2ème tube à essai. Ajouter un peu d'eau et adapter un
tube à dégagement de façon à pouvoir faire "buller" le gaz dans l'eau de chaux.
Que peut-on conclure ?
II- Dissolutions
1- Exploitation des documents
Redonner la solubilité de l'acide acétylsalicylique dans l'eau. Quelle est l'unité ?
Que représente cette donnée ?
Pourquoi avait-on dissous l'aspirine du Rhône dans l'éthanol pour identifier l'excipient dans
l'expérience n°1 ?
Que peut-on supposer de la solubilité de l'amidon dans l'éthanol ?
2- Mise en évidence expérimentale de la solubilité dans l'eau
Préparer 2 béchers contenant chacun 20 mL d'eau prélevés à l'éprouvette graduée.
Dans le premier bécher, introduire 1/2 comprimé d'Aspirine du Rhône®.
Verser la moitié du contenu d’un sachet de d'Aspégic® dans le second bécher.
Agiter à l’aide de l’agitateur en verre.
Que peut-on dire de la dissolution des 2 médicaments dans l'eau ?
Les observations concordent-elles avec les indications des documents 2 et 3 ? Préciser.

Thème : La santé sous-thème : Les médicaments TP Formulation et composition d’un médicament
3
III- Influence du milieu sur le médicament – Choix de la formulation
L’estomac est un milieu très acide (pH < 7) : la solution d’acide chlorhydrique permet de simuler le
milieu gastrique.
L’intestin est un milieu basique (pH > 7) : la solution d’hydroxyde de sodium permet de simuler le milieu
intestinal.
Expérience
Dans une coupelle, écraser délicatement le comprimé d'Aspirine pH8® de façon à séparer
l’enrobage du cachet.
Préparer deux tubes à essais contenant, l'un quelques millilitres de solution d'acide
chlorhydrique et l'autre quelques millilitres de solution d’hydroxyde de sodium.
Le premier tube représente le milieu acide de l’estomac et l’autre le milieu basique de
l’intestin.
Ajouter une goutte de BBT dans chaque tube (le BBT est jaune en milieu acide, bleu en milieu
basique).
Introduire dans chaque tube un échantillon de la pellicule d’enrobage du comprimé d'Aspirine
pH8®.
Agiter et observer.
Qu'observe-t-on ?
Quel est l'intérêt de l'enrobage du médicament ?
IV- Conclusion
Compte tenu des expériences et observations faites, quel est l’intérêt de disposer de plusieurs
formulations de l'aspirine ?
Document 1 : Définitions
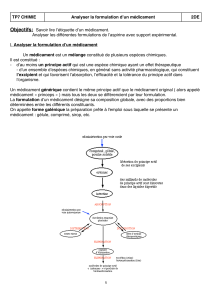
La forme sous laquelle se présente un médicament est appelé "forme galénique". Un médicament est
un mélange dont la composition précise est appelée "formulation". La galénique est donc "l'art de
formuler" un médicament et détermine son mode d'administration.
Un médicament est constitué de deux sortes de substances : d'une ou plusieurs substances actives ou
principe actif, possédant des propriétés thérapeutiques, faible proportion par rapport aux excipients
qui sont des substances auxiliaires, à priori inertes, servant à la formulation de la forme galénique.
La substance active peut être une substance pure bien définie chimiquement (molécule ou ion) ou un
mélange de plusieurs substances chimiquement proches (isomères, par exemple).
M
ilieu ………………………
M
ilieu ………………………

Thème : La santé sous-thème : Les médicaments TP Formulation et composition d’un médicament
4
Document 2 : Etiquettes de médicaments
Document 3 : Données physicochimiques
Document 4 : Effets indésirables
Document 3 : Données physicochimiques.
L'acide acétylsalicylique CH
3
– CO
2
– C
6
H
4
– CO
2
H (noté AH) est un acide faible.
Sa solubilité dans l’eau est faible (3,4 g.L
-1
à 25 °C).
Sa solubilité dans l’alcool est très bonne.
Sa base conjuguée, l’ion acétylsalicylate CH
3
– CO
2
– C
6
H
4
– CO
2-
(noté A
-
) est très soluble dans
l’eau : elle est hydrosoluble.
L’acide acétylsalicylique est lentement soluble dans les graisses : il est liposoluble. L’ion
acétylsalicylate ne l’est pas.
pH de la solution stomacale : 2 pH du milieu intestinal : 8
Document 4 : Effets indésirables
Les lésions induites par l’aspirine ne sont pas rares. Une étude réalisée par Nicholas Moore et al.
entre septembre 1997 et mars 1998 sur 8677 personnes rapporte que des effets gastro-intestinaux
indésirables sont survenus pour 17,6 % des patients traités à l’aspirine. L’acide acétylsalicylique se
dissout dans les graisses présentes dans la muqueuse de l’estomac. A dose élevée, l’aspirine favorise
les hémorragies digestives (risque augmenté de 2,61 fois). L’action irritante de l’aspirine sur l’estomac
serait due à son action inhibitrice sur la synthèse des prostaglandines qui protègent normalement la
muqueuse contre l’acidité gastrique. De nombreuses recherches pharmaceutiques ont été entreprises
afin d’améliorer la tolérance de ce médicament. Elles ont aboutit à la mise au point de différentes
formes pharmaceutiques.

Thème : La santé sous-thème : Les médicaments TP Formulation et composition d’un médicament
5
Document 3 : Données physicochimiques.
L'acide acétylsalicylique CH
3
– CO
2
– C
6
H
4
– CO
2
H (noté AH) est un acide faible.
Sa solubilité dans l’eau est faible (3,4 g.L
-1
à 25 °C).
Sa solubilité dans l’alcool est très bonne.
Sa base conjuguée, l’ion acétylsalicylate CH
3
– CO
2
– C
6
H
4
– CO
2-
(noté A
-
) est très soluble dans
l’eau : elle est hydrosoluble.
L’acide acétylsalicylique est lentement soluble dans les graisses : il est liposoluble. L’ion
acétylsalicylate ne l’est pas.
pH de la solution stomacale : 2 pH du milieu intestinal : 8
Document 4 : Effets indésirables
Les lésions induites par l’aspirine ne sont pas rares. Une étude réalisée par Nicholas Moore et al.
entre septembre 1997 et mars 1998 sur 8677 personnes rapporte que des effets gastro-intestinaux
indésirables sont survenus pour 17,6 % des patients traités à l’aspirine. L’acide acétylsalicylique se
dissout dans les graisses présentes dans la muqueuse de l’estomac. A dose élevée, l’aspirine favorise
les hémorragies digestives (risque augmenté de 2,61 fois). L’action irritante de l’aspirine sur l’estomac
serait due à son action inhibitrice sur la synthèse des prostaglandines qui protègent normalement la
muqueuse contre l’acidité gastrique. De nombreuses recherches pharmaceutiques ont été entreprises
afin d’améliorer la tolérance de ce médicament. Elles ont aboutit à la mise au point de différentes
formes pharmaceutiques.
 6
6
1
/
6
100%