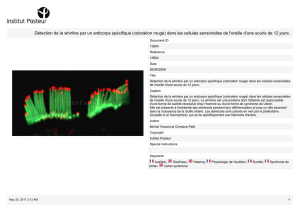
Bollettino n. 1 versione francese

Bulletin n° 1
1
Bulletin n°1, Mars 2003
Bulletin du réseau européen relatif à la surdité génétique (GENetic DEAFness): mécanismes
pathogènes, diagnostic clinique et moléculaire, impact social
COMITÉ DE RÉDACTION :
Rédacteur en chef :
Christina Fasser (RETINA International, Zurich) - Suisse
Rédacteurs
Patrizia Ceccarani (Lega del Filo d’Oro ONLUS, Osimo) - Italie
Manuela Mazzoli (U.O.A. Otochirurgia, Padova) - Italie
Vanessa Migliosi (International Federation of Hard of Hearing Young People, Trento) - Italie
Vibeke Leth (Danish Association for Cochlear Implanted Children, Skaevinge) - Danemark
Milon Potmesil (The Palacky University, Pedagogical Faculty, Department of Special Education,
Olomuc) – République Tchèque
Table des matières :
• Lettre de bienvenue à notre nouveau partenaire
• Section 1 – LE COIN DE LA RECHERCHE : “Quand une détérioration de l’audition peut-
elle être associée à un génotype spécifique?” (M. Mazzoli)
• Section 2 - “DERNIÈRES NOUVELLES” : “Syndrôme de Usher” (Le groupe de travail
WP3 sur le syndrôme de Usher)
• Section 3 - “LE COIN DE L'ASSOCIATION” : “Questionnaire sur le syndrôme de Usher :
projet CAUSE” (P. Ceccarani)
• Section 4 - “DIVERS” : Patients, clients et autres ? (M. Potmesil)
• Section 5 - “COURRIER DES LECTEURS”
• Section 6 -“RÉUNIONS ET ÉVÈNEMENTS”.
--- O ---
BIENVENUE À NOTRE NOUVEAU PARTENAIRE
Patrizia Ceccarani
Chers lecteurs,
En ce début d’année, le Dr Milon Potmesi, de la Faculté de Pédagogie de l'Université Palacky
d'Olmut, (République Tchèque) a intégré notre groupe de travail.
Chaque membre du groupe s'est engagé, non seulement à communiquer des informations
concernant le projet GENDEAF aux associations de patients impliquées, mais également à
communiquer des informations au grand public des pays membres.
Grâce à notre nouveau membre, les nouvelles du projet GENDEAF atteindront également l'Europe
de l'Est. Notre bulletin peut désormais être également lu en langue tchèque sur le site de Gendeaf,
www.gendeaf.org.

Bulletin n° 1
2
J'aimerais profiter de cette occasion pour remercier Anders Lundgren qui, depuis avril 2003,
travaille comme consultant au sein du groupe de travail WP7.
--- O ---
SECTION 1 – LE COIN DE LA RECHERCHE
QUAND UNE DÉTÉRIORATION DE L’AUDITION PEUT-ELLE ÊTRE ASSOCIÉE À UN
GÉNOTYPE SPÉCIFIQUE?
Manuela Mazzoli
Lorsqu'un individu atteint d'une perte auditive apprend que son état pourrait être héréditaire, de
nombreuses questions auxquelles il est souvent difficile de répondre apparaissent.
Dans le cas de troubles syndromiques, une certaine présentation clinique où plusieurs symptômes
caractéristiques du syndrôme sont présents est, en général, fortement révélatrice du trouble
héréditaire l'ayant provoqué. Malheureusement, la grande majorité des pertes auditives héréditaires
sont non-syndromiques et la perte auditive en est le seul symptôme. Une perte auditive peut
présenter différentes caractéristiques : elle peut affecter différentes fréquences et présenter
différents degrés de gravité, elle peut être clairement familiale ou n'affecter qu'un seul membre de la
famille, être congénitale ou n'apparaître que plus tard, elle peut progresser ou être stable durant
toute la vie, etc. Néanmoins, les caractéristiques cliniques (phénotypes), ne sont pas uniques pour un
génotype spécifique (c'est-à-dire la constitution génétique d'une personne).
Le nombre de gènes impliqués dans la perte auditive génétique est inconnu, mais on pense que des
mutations dans au moins 100 gènes peuvent être associées à une perte auditive. Par conséquent, en
dépit du fait que la perte auditive est relativement fréquente (1-2/1000 nouveau-nés souffrent de
perte auditive profonde), l'occurrence de chaque trouble est rare. Pour cette raison, un dépistage de
toutes les maladies génétiques possibles pour chaque individu affecté par une perte auditive serait
trop coûteux et trop long à effectuer. Par conséquent, il serait utile d'identifier des corrélations
spécifiques, des indices, dans la présentation clinique susceptibles d'indiquer la maladie génétique à
l'origine des troubles.
La plupart du temps, il n'est pas facile d'identifier la maladie génétique à l'origine de la perte
auditive d'après sa présentation clinique. Il y a différents aspects qui contribuent à la difficulté de la
mise en corrélation d'un phénotype et d'un génotype dans les cas de perte auditive non
syndromique.
Les troubles génétiques de l'audition ne peuvent être classés de manière rigide entre syndromiques
et non syndromiques car les mécanismes pathogénétiques impliqués peuvent être complexes et les
mutations dans un même gène peuvent donner lieu, dans certains cas, à une perte auditive à la fois
syndromique et non syndromique. Par exemple, des mutations du gène pendrin gene (PDS),
peuvent entraîner une perte auditive autosomique récessive non syndromique(1) (DFNB4) ou
l'apparition du syndrôme de Pendred caractérisé par une perte auditive et un goitre. Un autre
exemple est donné par des mutations du gène USH2A qui peuvent donner lieu à des dépôts
pigmentaires sur la rétine et à une perte auditive (syndrôme de Usher) ou à des dépôts pigmentaires
sur la rétine uniquement.
De même, des mutations d'un même gène peuvent être responsables d'une hérédité sur un mode
autosomique dominant(2) ou sur un mode autosomique récessif. Par exemple, des mutations du gène
MYO7A peuvent être responsables d'une perte auditive autsomique dominante non syndromique
DFNA11 ou d'une perte auditive autosomique récessive non syndromique DFNB2 ainsi que d'un
syndrôme de Usher de type 1B.

Bulletin n° 1
3
D'autres mécanismes génétiques complexes peuvent consister en : maladies oligogéniques ou
polygéniques, pénétrance incomplète, interaction entre ADN mitochondrial et nucléaire, interaction
entre des facteurs environnementaux et un profil génétique, co-présence de gènes modificateurs.
Une pénétrance incomplète représente la probabilité qu'un certain phénotype soit exprimé en
présence d'un certain génotype. Une pénétrance complète (100%) signifie qu'une certaine mutation
génère toujours un phénotype donné. Dans plusieurs cas de pertes auditives héréditair es (le plus
souvent les surdités de type autosomique dominant avec déclenchement tardif), la pénétrance n'est
pas complète. Ceci pourrait partiellement expliquer la variabilité clinique et soulève l'hypothèse
selon laquelle davantage de gènes interagiraient pour déterminer le phénotype ou selon laquelle il
existerait une interaction avec des facteurs environnementaux.
Un nouveau mécanisme génétique impliqué dans la génétique de la surdité a été observé par
Riazuddin et al. (2000). Dans une famille présentant des cas de pertes auditives autosomiques
récessives non syndromiques, ils ont identifié un locus génétique “modificateur”(3) qui protégerait
l'individu contre le développement d'une maladie de l'audition.
Il existe également différents aspects dans la présentation clinique des pertes auditives non
syndromiques qui contribuent à rendre difficile la mise en corrélation entre le génotype et le
phénotype : la présentation clinique est très hétérogène entre les familles, mais également au sein
d'une même famille, il y a un manque de spécificité dans les présentations cliniques (par ex., les
pertes auditives dues à une naissance prématurée, à des infections, au bruit, etc. ne peuvent être
différentiées des pertes auditives héréditaires à partir des simples tests audiologiques) et
l'interaction avec l'âge et les facteurs environnementaux qui peuvent produire des dommages
supplémentaires à la perte auditive héréditaire sous-jacente.
Les problèmes soulevés par la corrélation génotype - phénotype ont été traités lors des projets
suivants financés par l'Union européenne : le projet HEAR (1996-1999) et le projet GENDEAF
toujours en cours. Ces projets ont été importants dans la mesure où ils ont permis de standardiser la
terminologie et les protocoles et de créer le réseau multidisciplinaire nécessaire pour étudier les
maladies rares.
Dans le cadre du projet HEAR, un certain nombre de caractéristiques cliniques a été proposé afin de
classer les troubles génétiques de l'audition. Malgré cela, dans la littérature, la plupart des
informations sont toujours manquantes, notamment en ce qui concerne la fonction vestibulaire,
l'acouphène, la progression, la variabilité inter familiale. Dans le cadre du projet GENDEAF, des
recommandations ont été faites en vue de créer une meilleure définition des maladies décrites dans
les articles scientifiques et d'aider le recueil de données relatives à une corrélation génotype-
phénotype. Ces recommandations sont publiées sur le site : http://www.gende af.org.
La gravité varie fortement selon les troubles. Les troubles autosomiques dominants tendent à être
moins graves que les troubles autosomiques récessifs. Il est également clair qu'aucune
caractéristique spécifique ne peut être identifiée pour un génotype donné. Par exemple, plusieurs
maladies peuvent donner naissance à une perte auditive au niveau des hautes fréquences ou
impliquer toutes les fréquences. Bien que ce ne soit pas toujours le cas, une maladie récessive
conduit plus souvent à une perte auditive précoce et profonde tandis que les maladies autosomiques
dominantes peuvent aller d'une perte auditive légère à une perte auditive profonde impliquant
plusieurs fréquences.
Même dans les maladies autosomiques dominantes, lorsque l'histoire de la famille suggère
clairement une forme héréditaire de perte auditive, une certaine caractéristique audiométrique
n'oriente pas notre diagnostic vers le génotype sous-jacent, à cause d'un manque de spécificité.
Ce n'est que dans le cas des pertes auditives impliquant les basses fréquences qu'une corrélation
phénotype/génotype peut être établie.

Bulletin n° 1
4
En 1968, Teig a décrit une grande famille caractérisée par des pertes auditives impliquant les basses
fréquences avec une hérédité autosomique dominante. Le locus de cette famille a été désigné
comme étant DFNA6 et relié au chromosome 4p16.3 en 1995 (Lesperance et al. 1995). Un
troisième locus (DFNA14) pour les pertes auditives impliquant les basses fréquences a été relié aux
environs de la région DFNA6, sans toutefois présenter de recouvrement apparent (Van Camp et at.,
1999). Récemment, Bespalova et al. (2001) ont indiqué que DFNA6 et DFNA14 correspondent à la
même maladie et ont identifié des mutations dans le gène du syndrôme de Wolfram de type 1
(WFS1). Simultanément, Young et al. (2001) ont identifié des mutations du gène WFS1 au sein
d'un locus codé DFNA38 qui a été relié à une maladie dont la présentation clinique est
apparemment semblable.
Les familles DFNA6/14 montraient une implication bilatérale, symétrique, à déclenchement
précoce au niveau des fréquences les plus basses. Des mutations dans le même gène sont
responsables du syndrôme de Warfran qui présente un mode d'hérédité autosomique récessif et est
caractérisé par un diabète sucré et une atrophie oculaire, avec des symptômes supplémentaires tels
que diabète insipide, surdité de perception, ataxie, neuropathie périphérique, atonie du canal
urinaire et maladie psychiatrique. La perte auditive chez ces patients affecte les hautes fréquences
(Cremers et. al, 1977; Higashi, 1991). Les mutations à l'origine de la perte auditive n'inactivent pas
les protéines. Les mutations provoquant les syndrômes de Warfran les plus sévères inactivent la
plupart des protéines leur permettant de fonctionner correctement
(http://www.uia.ac.be/dnalab/hhh/).
Dans ce cas, il était possible de mettre en corrélation le phénotype avec les mutations et le type de
modification dans la fonction induit par le produit du gène. L'avantage du DFNA6/14 est que seule
une autre maladie, la DFNA1, affecte les fréquences les plus basses. Cela semble être moins
fréquent, ce qui réduit la gamme de possibilités de diagnostics en présence de perte auditive
impliquant des basses fréquences. Cet exemple montre également la manière dont la connaissance
d'une maladie est acquise au cours des années ainsi que le besoin de mettre à jour les informations
en permanence.
Dans le cadre du projet GEDEAF, nous analysons actuellement la corrélation possible entre les
différentes mutations du gène de la connexe 26 et les caractéristiques cliniques correspondantes,
cette maladie étant plus fréquente que les autres et une grande quantité de données ayant été
recueillie. D'autres projets plus ou moins en rapport étudient les maladies héréditaires complexes de
l'audition telles que la surdité provoquée par le vieillissement (projet européen ARHI -
http://www.uia.ac.be/u/arhi/) et l'otosclérose. Ces projets pourraient contribuer à une meilleure
compréhension de certains des mécanismes qui interviennent dans l'expression des gènes et dans la
fonction de l'audition et peut-être même apporter quelques lumières sur les mécanismes qui
interviennent dans d'autres troubles.
Notes :
Hérédité autosomique - La transmission d'un allèle transporté par un autosome. L'hérédité
autosomique est suspectée lorsqu'un caractère peut être transmis par un parent (père ou mère) à un
enfant (garçon ou fille).
1. Autosomique récessive – Le modèle de pedigree observé lorsqu'un allèle d'un locus autosomique
cause un caractère récessif.
Description du pedigree de l'hérédité autosomique récessive. Les hommes comme les femmes
peuvent être affectés. Si les parents des individus affectés sont consanguins, alors l'hérédité
récessive est la plus probable, mais pas certaine. Généralement, seuls les individus d'une seule et
même fratrie sont affectés; les parents et les autres membres de la famille ne sont généralement pas
affectés. Dans la plupart des cas, il n'y a qu'un seul individu de la famille affecté, ce qui rend le
modèle de pedigree difficile à identifier comme autosomique récessif.

Bulletin n° 1
5
2. Autosomique dominant – Le modèle de pedigree observé lorsqu'un allèle d'un locus autosomique
cause un caractère dominant.
Description du pedigree de l'hérédité autosomique dominante. Les hommes comme les femmes
peuvent être affectés. Le trouble est transmis de génération en génération et peut être transmis de
toutes les manières possibles ; de femme à femme, de femme à homme, d' homme à femme et
d'homme à homme. Des études de ségrégation formelles visant à déterminer si le ratio est 1:1
affecté: non affecté dans la famille de l'individu sont généralement impossibles. Dans les petites
familles, le mode d'hérédité peut être difficile à déterminer, mais la transmission d'une maladie rare
à travers trois générations est une bonne preuve que l'hérédité est dominante. De nombreuses
maladies dominantes sont variables (même au sein des familles) et peuvent sauter des générations.
3. Locus – Il s'agit de la position qu'occupe un gène sur un chromosome. Les gens ayant une paire
de chaque autosome, une personne possède deux allèles (identiques ou différents) sur chaque locus
autosomique.
BIBLIOGRAPHIE
Bespalova IN, Van Camp G, Bom SJH, Brown DJ, Cryns K, DeWan AT, Erson AE, Flothmann K,
Kunst HPM, Kurnool P, Sivakumaran TA, Cremers CWRJ, Leal SM, Burmeister M, Lesperance
MM. Mutations in the Wolfram syndrome 1 gene (WFS1) are a common cause of low frequency
sensorineural hearing loss. Human Molecular Genetics 2001; 10: 2501-2508.
Cremers C.W.R.J., Wijdeveld P.G., Pinkers A.J. Juvenile diabetes mellitus, optic atrophy, hearing
loss, diabetes insipidus, atonia of the urinary tract and bladder, and other abnormalities (Wolfram
syndrome). A review of 88 cases from the literature with personal observations on 3 new patients.
Acta Paediatr Scand Suppl. 1977; 264:1-16.
Higashi K. Otologic findings of DIDMOAD syndrome. Am J Otol, 1991; 12:57-60.
Lesperance MM, Hall JW III, Bess FH, Fukushima K, Jain PK, Ploplis B, San Agustin TB, Skarka
H, Smith RJH, Wills M, Wilcox ER. A gene for autosomal dominant nonsyndromic hereditary
hearing impairment maps to 4p16.3. Human Molecular Genetics, 1995; 4: 1967-1972.
Riazuddin S, Castelein CM, Ahmed ZM, Lalwani AK, Mastroianni MA, Naz S, Smith TN, Liburd
NA, Friedman TB, Griffith AJ, Riazuddin S, Wilcox ER. Dominant modifier DFNM1 suppresses
recessive deafness DFNB26. Nature Genetics 2000 Dec. 26(4):431-4.
Teig E. Hereditary progressive perceptive deafness in a family of 72 patients. Acta
Otolaryngologica, 1968; 65: 365-372.
Van Camp G, Kunst H, Flothmann K, McGuirt W, Wauters J, Marres H, Verstreken M, Bespalova
IN, Burmeister M, Van de Heyning PH, Smith RJH, Willems PJ, Cremers CWRJ, Lesperance MM.
A gene for autosomal dominant hearing impairment (DFNA14) maps to a region on chromosome
4p16.3 that does not overlap the DFNA6 locus. Journal of Medical Genetics, 1999; 36: 532-536.
Van Camp G, Smith RJH. Hereditary Hearing Loss Homepage (HHH). Van Camp G. and Smith
RJH. Disponible sur le site : http://www.uia.ac.be/dnalab/hhh. Dernier accès : mars 2003.
Young T-L, Ives E, Lynch E, Person R, Snook S, MacLaren L, Cator T, Griffin A, Fernandez B,
Lee MK, King M-C. Non-syndromic progressive hearing loss DFNA38 is caused by heterozygous
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%