cas image Rôle différentiel des protéines de tégument interne

cas image
Rôle différentiel des protéines de tégument
interne pUL36 et pUL37 du virus Herpes Simplex
type 1 dans l’entrée du génome viral
dans le noyau
A. Roberts
F.J. Rixon
D. Pasdeloup
MRC Virology Unit, Church Street,
Glasgow G11 5JR, Écosse
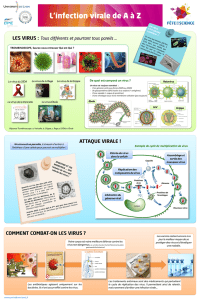
Les Herpèsvirus sont des virus enveloppés à ADN de grande taille à la compo-
sition complexe. Ainsi, la particule virale est composée de trois structures
majeures [1] : la capside contenant le génome, la membrane virale contenant les
glycoprotéines d’enveloppe et, entre la capside et la membrane, le tégument, une
couche de protéines amorphe dont la structure et la fonction restent floues.
La particule virale fusionne à la membrane plasmique ou au niveau des endoso-
mes. Après fusion, la capside est relarguée dans le cytoplasme et le tégument est
perdu à l’exception de deux protéines : pUL36 et pUL37 [2]. La capside migre
vers le noyau à l’aide du réseau de microtubules et s’attache au pore nucléaire à
travers duquel l’ADN viral est injecté dans le noyau. Démarre alors le cycle
réplicatif avec formation de nouvelles capsides dans le noyau dont elles s’échap-
pent par un mécanisme d’enveloppement à la membrane interne de l’enveloppe
nucléaire et de désenveloppement à la membrane externe. Une fois dans le
cytoplasme, les capsides subissent un « enveloppement secondaire » au niveau
de la membrane du trans-golgi, où sont accumulées les glycoprotéines virales,
puis sont exocytées [3].
Le fait que les protéines pUL36 et pUL37 soient les seules protéines de tégument
à rester associées à la capside lors de sa migration vers le noyau laisse penser
qu’elles peuvent jouer un rôle dans les étapes précoces de l’infection.
Lors de nos travaux, nous avons mis en évidence que la protéine pUL36 est
nécessaire à la transmission de l’ADN viral dans le noyau alors que pUL37 n’est
pas requise.
Les protéines du tégument pUL36 et pUL37 font partie du tégument rattaché à la
capside ou « tégument interne » (figure 1A) et sont nécessaires à l’enveloppe-
ment de la capside au niveau du réseau trans-golgien [4,5]. Par ailleurs, ces
protéines sont les seuls composants du tégument à rester associés à la capside
après fusion à la membrane plasmique de la cellule [2]. Malheureusement, du
fait que pUL36 et pUL37 sont strictement nécessaires à la morphogenèse virale,
il n’a pas pu être possible d’étudier clairement leur rôle dans les étapes précoces
d’infection. Afin de contourner ce problème, nous avons développé un système
d’infection de cellules polynucléées (syncytia) ainsi que deux virus dérivés du
virus Herpes Simplex type 1 (HSV-1), ARD36 et FRD37, délétés pour les gènes
UL36 et UL37 respectivement. Ce système est illustré en figure 1B, dans le cas
d’un virus non modifié. Des cellules HFFF sont infectées à une multiplicité
d’infection de 0,01 de façon à infecter un petit nombre de cellules (a). Les
cellules sont fusionnées post-infection et incubées 24 heures. Pendant ce temps,
le noyau infecté produit de nouvelles capsides qui sont relâchées dans le
cytoplasme. De là, elles peuvent s’arrimer à des noyaux non infectés et y délivrer
leur génome (b). L’infection progresse et de nouvelles capsides sont produites
qui peuvent infecter de nouveaux noyaux (c). Après 24 heures, tous les noyaux
sont infectés et l’ADN viral y est détectable en concentration croissante depuis le
doi: 10.1684/vir.2008.0185
Virologie 2008, 12 (4) : 301-3
Virologie, Vol. 12, n° 4, juillet-août 2008
301
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

noyau originaire de l’infection (d). Le génome viral est
détecté par FISH (Hybridation In-Situ Fluorescente) à
l’aide d’une sonde spécifique couplée au Cy3 (rouge). Lors
d’une infection par le virus sauvage, la transmission du
génome viral depuis un unique noyau infecté vers les
noyaux adjacents est effective (figure 1C,WT).Enrevan-
a. b. c. d.
Glycoprotéines
Tégument externe
Capside contentant I'ADN viral
Tégument interne
VHS
VP11/12
VP13/14
VP16
VP22...
pUL36
pUL37
A
B
C
D
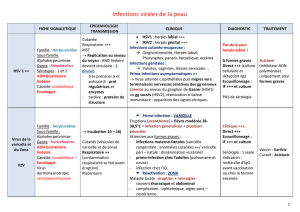
Figure 1. Transmission du génome viral de HSV-1 dans des syncytia. (A) Description de la particule virale de l’Herpes Simplex Virus 1.
(B) Illustration de la transmission du génome de HSV-1 de noyau à noyau dans un syncytium infecté par le virus wt. (C) Transmission du
génome de HSV-1 de noyau à noyau dans un syncytium infecté. L’ADN viral est détecté par FISH (Fluorescent In Situ Hybridisation,
rouge), les noyaux sont marqués au DAPI (bleu). Les différents virus testés sont le virus sauvage (WT), le virus K5DZ ne codant pas la
protéine majeure de capside et ne produisant donc pas de capside, ainsi que les virus mutants FRD37 et ARD36, respectivement délétés
pour l’intégralité des gènes UL37 et UL36. (*) indique le noyau originellement infecté ; (∇) indique les noyaux infectés pour la photo FRD37.
Barres : 20 lm. (D) Illustration de l’absence de la transmission du génome de HSV-1 de noyau à noyau dans un syncitium infecté par le
virus ARD36.
cas image
Virologie, Vol. 12, n° 4, juillet-août 2008
302
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

che, un virus ne codant pas pour la protéine majeure de
capside et donc ne produisant pas de capside ne montre
aucune transmission du génome viral (figure 1C,K5DZ).
Ce phénotype est retrouvé lors de l’infection avec le virus
ARD36, à la différence que les génomes viraux individuels
sont détectables dans le cytoplasme, montrant que les cap-
sides sont formées et s’accumulent dans le cytoplasme mais
ne sont pas en mesure de transmettre le génome aux noyaux
avoisinants (figure 1C,ARD36). Cela contraste avec le
phénotype du virus délété pour UL37, pour lequel on dé-
tecte le génome viral dans tous les noyaux du syncytium
(figure 1C,FRD37). Des agglomérats de génomes sont
observables dans le cytoplasme, ce qui corrèle les données
précédemment publiées selon lesquelles en absence de
pUL37, les capsides forment des agrégats cytoplasmiques
[5]. Nous déduisons de ces observations que pUL36 est
nécessaire à la transmission de l’ADN viral de la capside au
noyau ou à une étape préliminaire telle que l’association
des capsides au pore nucléaire. En l’absence de pUL36, les
capsides s’accumulent dans le cytoplasme des syncytias
infectés sans transmettre leur génome (figure 1D).En
conclusion, nos résultats confirment le rôle suspecté du
tégument interne dans la transmission du génome viral de la
capside au noyau, démontrant également que seule pUL36
est requise pour cette étape et non pUL37.
Références
1. Grunewald K, Desai P, Winkler DC, et al. Three-dimensional structure
of herpes simplex virus from cryo-electron tomography. Science 2003 ;
302 : 1396-8.
2. Luxton GW, Haverlock S, Coller KE, et al. Targeting of herpesvirus
capsid transport in axons is coupled to association with specific sets of
tegument proteins. Proc Natl Acad Sci USA 2005 ; 102 : 5832-7.
3. Mettenleiter TC. Budding events in herpesvirus morphogenesis. Virus
Res 2004 ; 106 : 167-80.
4. Desai PJ. A null mutation in the UL36 gene of herpes simplex virus type
1 results in accumulation of unenveloped DNA-filled capsids in the
cytoplasm of infected cells. J Virol 2000 ; 74 : 11608-18.
5. Desai P, Sexton GL, McCaffery JM, et al. A null mutation in the gene
encoding the herpes simplex virus type 1 UL37 polypeptide abrogates
virus maturation. JVirol2001 ; 75 : 10259-71.
cas image
Virologie, Vol. 12, n° 4, juillet-août 2008
303
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
3
100%