Roche présentera de nouvelles données cliniques relatives à

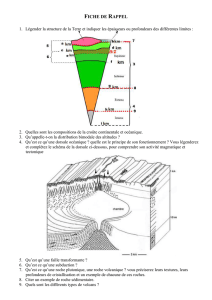
Communiqué de presse
F. Hoffmann-La Roche SA 4070 Bâle
Suisse
Group Communications
Relations avec les médias,
groupe Roche
Tél. +41 61 688 88 88
Fax +41 61 688 27 75
www.roche.com
1/5
Bâle, le 5 novembre 2015
Roche présentera de nouvelles données cliniques relatives à diverses maladies du
sang lors du congrès annuel 2015 de l’American Society of Hematology
Gazyva/Gazyvaro (obinutuzumab) ainsi que le venetoclax et l’ACE910, deux principes actifs
expérimentaux, font partie des médicaments qui seront mis en lumière au congrès
Des demandes d’autorisation de mise sur le marché pour Gazyva/Gazyvaro ont été déposées auprès
des autorités de santé sur la base des résultats de l’étude GADOLIN; procedure d’examen prioritaire
accordée par la FDA
Des données pivots portant sur le venetoclax dans le traitement de la leucémie lymphoïde chronique
récidivante/réfractaire présentant une délétion 17p ont été soumises à la Food and Drug
Administration américaine
Roche (SIX: RO, ROG; OTCQX: RHHBY) a annoncé aujourd’hui la présentation de plus de 45 abstracts
portant sur huit de ses médicaments homologués ou expérimentaux durant le 57e congrès annuel de
l’American Society of Hematology (ASH), qui se tiendra du 5 au 8 décembre à Orlando. Parmi les abstracts
figurent plus de 15 présentations orales couvrant un large éventail de cibles moléculaires et d’associations,
ainsi que plusieurs critères d’évaluation clinique étudiés par Roche dans différentes maladies du sang et lignes
de traitement.
«Les données que nous présentons cette année au congrès de l’ASH témoignent de l’évolution de notre
portefeuille de produits à visée hématologique et reflètent de futures approches potentielles pour venir en
aide aux patients atteints de cancers hématologiques et d’affections sanguines, a déclaré Sandra Horning,
M.D., Chief Medical Officer et Head of Global Product Development. Nous sommes particulièrement
enthousiastes au vu des études évaluant de nouvelles associations avec Gazyva/Gazyvaro et le venetoclax,
ainsi qu’au vu des études examinant la significativité clinique potentielle de l’absence de maladie résiduelle
minime.»
Parmi les données relatives à Gazyva/Gazyvaro figurent des résultats d’études, telles que l’étude de phase IIIb
GREEN et les études pivots CLL11 et GADOLIN, évaluant ce médicament dans le cadre d’associations. Les

2
/
5
résultats de l’étude GREEN comprennent des données relatives à Gazyva/Gazyvaro en association avec la
bendamustine lors de leucémie lymphoïde chronique (LLC) non précédemment traitée. Roche
communiquera également des résultats actualisés de l’étude de phase III CLL11, sur lesquels a reposé
l’homologation de Gazyva/Gazyvaro en association avec le chlorambucil lors de LLC non précédemment
traitée, ainsi que des données complémentaires issues de l’étude pivot de phase III GADOLIN portant sur
l’utilisation expérimentale de Gazyva/Gazyvaro chez des patients atteints de lymphome non hodgkinien
(LNH) indolent réfractaire à un traitement à base de MabThera/Rituxan (rituximab), qui s’ajoutent aux
résultats positifs présentés en juin lors du congrès annuel de l’American Society of Clinical Oncology
(ASCO).
Roche présentera en outre les résultats de plusieurs études laissant penser que l’absence de maladie résiduelle
minime (minimal residual disease, MRD) pourrait jouer un rôle dans le traitement de certains cancers
hématologiques. En collaboration avec AbbVie, Roche fera part de nouvelles données concernant le
venetoclax, médicament expérimental administré en monothérapie ou en association avec d’autres
médicaments lors de divers cancers hématologiques, dont la LLC, le lymphome non hodgkinien (LNH), le
myélome multiple (MM) et la leucémie myéloïde aiguë (LMA). Des données seront également présentées en
ce qui concerne le médicament expérimental ACE910, auquel la FDA a récemment accordé le statut de
percée thérapeutique (Breakthrough Therapy Designation) pour le traitement prophylactique des patients à
partir de l’âge de 12 ans atteints d’hémophilie A avec inhibiteurs du facteur VIII.
Le tableau ci-dessous récapitule les principaux abstracts concernant des médicaments de Roche qui seront
présentés au congrès. Suivez Roche sur Twitter via @roche et recevez toutes les nouvelles et informations du
congrès annuel de l’ASH en utilisant le hashtag #ASH2015.
Par ailleurs, la FDA a accepté d’examiner en priorité, sur la base des résultats de l’étude GADOLIN, la
demande de licence biologique supplémentaire (supplemental Biologics License Application, sBLA) pour
Gazyva/Gazyvaro dans le traitement de patients atteints de lymphome folliculaire (LF) en rechute après un
protocole thérapeutique contenant du rituximab ou réfractaires à ce protocole. Des demandes d’autorisation
de mise sur le marché de Gazyva/Gazyvaro ont également été déposées auprès d’autres autorités de
réglementation, dont l’Agence européenne des médicaments, en vue de son homologation pour le traitement
de patients dont le LF n’a pas répondu ou a progressé pendant un traitement par le rituximab ou un
protocole thérapeutique contenant du rituximab, ou au cours d’une période allant jusqu’à 6 mois après un tel
traitement. En outre, AbbVie a soumis à la FDA une demande d’homologation (New Drug Application,

3
/
5
NDA) du venetoclax dans le cadre du statut de percée thérapeutique (Breakthrough Therapy Designation)
reposant en partie sur les résultats de l’étude pivot de phase II M13-982 évaluant le venetoclax chez des
patients atteints de LLC récidivante ou réfractaire présentant la délétion 17p. Roche et AbbVie ont annoncé
cette année des résultats préliminaires positifs pour cette étude.
Vue d’ensemble des principales présentations portant sur des médicaments de Roche lors de l’ASH 2015
Medicament/thème Titre de l’abstract Numéro de l’abstract
Gazyva/Gazyvaro
(utilisation
expérimentale)
GREEN: Safety and Efficacy of Obinutuzumab Plus
Bendamustine in Previously Untreated Patients with
Chronic Lymphocytic Leukemia: subgroup analysis of the
GREEN study
#493 (présentation orale)
Lundi 7 décemb re
07 h 00 HE
GADOLIN: Analysis of Minimal Residual Disease in
Follicular Lymphoma Patients in GADOLIN, a Phase III
Study of Obinutuzumab plus Bendamustine versus
Bendamustine in Relapsed/Refractory Indolent Non-
Hodgkin Lymphoma
#3978 (discussion sur le poster)
Lundi 7 décemb re
06 h-08 h 00 HE
GADOLIN: Primary Results of the Health-Related
Quality of Life Assessment from the Phase III GADOLIN
Study of Obinutuzumab Plus Bendamustine Compared
with Bendamustine Alone in Patients with Rituximab-
Refractory, Indolent Non-Hodgkin Lymphoma
#1532 (discussion sur le poster)
Samedi 5 décembre
5h 30-7h 30 HE
Gazyva/Gazyvaro
(utilisation
conforme à l'AMM)
CLL11: Updated Survival Analysis from the CLL11
Study: Obinutuzumab Versus Rituximab in
Chemoimmunotherapy Treated Patients with Chronic
Lymphocytic Leukemia
#1733 (discussion sur le poster)
Samedi 5 décembre
5h 30-7h 30 HE
Maladie résiduelle
(MRD)
A Model for Predicting Effect of Treatment on
Progression-Free Survival Using Minimal Residual
Disease As a Surrogate Endpoint in Chronic
Lymphocytic Leukemia
#720 (présentation orale)
Lundi 7 décemb re
16 h 00 HE
Venetoclax (GDC-
0199/ABT-199)
(expérimental)
GP28331: Safety and Efficacy of a Combination of
Venetoclax (GDC0199/ABT199) and Obinutuzumab in
Patients with Relapsed/Refractory or Previously
Untreated Chronic Lymphocytic Leukemia Results from
a Phase 1b Study (GP28331)
#494 (présentation orale)
Lundi 7 décembre
7 h 15 HE
CLL14: Results of the Safety Run in Phase of CLL14
(BO25323): A Prospective, Open Label, Multicenter
Randomized Phase III Trial to Compare the Efficacy and
Safety of Obinutuzumab and Venetoclax (GDC0199/
#496 (présentation orale)
Lundi 7 décembre
7 h 45 HE

4
/
5
ABT199) with Obinutuzumab and Chlorambucil in
Patients with Previously Untreated CLL and Coexisting
Medical Conditions
M13-365: Deep and Durable Responses Following
Venetoclax (ABT-199 / GDC-0199) Combined with
Rituximab in Patients with Relapsed/Refractory Chronic
Lymphocytic Leukemia: Results from a Phase 1b Study
#830 (presentation orale)
Lundi 7 décembre
4 h 45 HE
M12-630: A Dose-Escalation Study of Venetoclax (ABT-
199/GDC-0199) in Combination with Bendamustine and
Rituximab in Patients with Relapsed or Refractory Non-
Hodgkin's Lymphoma
#255 (présentation orale)
Dimanche 6 décembre
12 h 30 HE
M14-358: A Phase 1b Study of Venetoclax (ABT-
199/GDC-0199) in Combination with Decitabine or
Azacitidine in Treatment-Naive Patients with Acute
Myelogenous Leukemia Who Are Greater Than or Equal
to 65 Years and Not Eligible for Standard Induction
Therapy
#327 (presentation orale)
Dimanche 6 décembre
5h 00 HE
A propos de Roche en hématologie
Depuis plus de 20 ans, Roche développe des médicaments qui font référence en hématologie. Aujourd’hui,
Roche s’investit plus que jamais dans la recherche d’options thérapeutiques novatrices pour les patients
souffrant de maladies du sang. Dans le domaine des médicaments expérimentaux à visée hématologique, le
pipeline de Roche contient, outre les produits homologués MabThera®/Rituxan® (rituximab) et
Gazyva®/Gazyvaro® (obinutuzumab), un anticorps anti-PDL1 (atezolizumab/MPDL3280A), un conjugué
anticorps-médicament anti-CD79b (polatuzumab vedotin/RG7596), une petite molécule antagonisant le
MDM2 (idasanutline/RG7388) et, en collaboration avec AbbVie, une petite molécule inhibant le BCL-2
(venetoclax/RG7601/GDC-0199/ABT-199). Par ailleurs, la détermination de Roche à développer de
nouvelles molécules en hématologie va au-delà du domaine de l’oncologie, comme en témoigne le
développement de la substance expérimentale ACE910 contre l’hémophilie A.
A propos de Roche
Roche, dont le siège est à Bâle, Suisse, figure parmi les leaders de l’industrie pharmaceutique et diagnostique
axée sur la recherche. Numéro un mondial de la biotechnologie, Roche produit des médicaments
cliniquement différenciés pour l’oncologie, l’immunologie, les maladies infectieuses, l’ophtalmologie et les
neurosciences. Roche est aussi le leader mondial du diagnostic in vitro ainsi que du diagnostic histologique
du cancer, et une entreprise d’avant-garde dans la gestion du diabète. Sa stratégie des soins personnalisés vise

5
/
5
à mettre à disposition des médicaments et des produits diagnostiques permettant d’améliorer de façon
tangible la santé ainsi que la qualité et la durée de vie des patients. Depuis sa fondation, en 1896, Roche n’a
cessé d’apporter une contribution majeure dans le domaine de la santé, au niveau mondial. Vingt-neuf
médicaments développés par Roche font partie de la Liste modèle de Médicaments Essentiels de
l’Organisation Mondiale de la Santé, notamment des antibiotiques, des traitements antipaludéens et des
agents chimiothérapiques permettant de sauver des vies.
En 2014, le groupe Roche, qui comptait 88 500 employés dans le monde, a consacré 8,9 milliards de francs
suisses à la recherche et au développement. Son chiffre d’affaires s’est élevé à 47,5 milliards de francs suisses.
Genentech, aux Etats-Unis, appartient entièrement au groupe Roche, qui est par ailleurs l’actionnaire
majoritaire de Chugai Pharmaceutical, Japon. Pour de plus amples informations, veuillez consulter
www.roche.com.
Tous les noms de marque mentionnés sont protégés par la loi.
Informations complémentaires
Roche en oncologie: www.roche.com/media/media_backgrounder/media_oncology.htm
Relations avec les médias, groupe Roche
Téléphone: +41 -61 688 8888 / e-mail: roche.mediarelations@roche.com
- Nicolas Dunant (responsable du bureau des médias)
- Ulrike Engels-Lange
- Nicole Rüppel
- Claudia Schmitt
1
/
5
100%