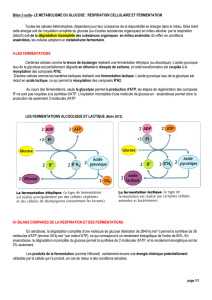
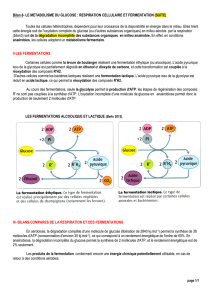
DIA1 - GIGA

1
CHAPITRE 1 : BIOENERGETIQUE :
DIA1 :
Le métabolisme cellulaire est constitué d’un ensemble de réactions (bio)chimiques
qui permettent à la cellule de survivre, de se différencier, de se diviser et d’assurer
ses fonctions physiologiques.
Ce métabolisme cellulaire « se nourrit » notamment de molécules exogènes
« simples » qui proviennent de l’ingestion et de la digestion d’aliments par
l’organisme multicellulaire. Les molécules exogènes simples qui dérivent du
processus de digestion sont ensuite absorbées dans la circulation sanguine et
transportées vers les cellules.
Ces molécules exogènes simples sont, par exemple, des glucides (glucose
provenant de polysaccharides alimentaires), des lipides simples (acides gras et
glycerol provenant de lipides complexes alimentaires), des acides aminés (provenant
de protéines alimentaires) et des nucléotides (provenant d’acides nucléiques : ADN
et ARN des cellules ingérées).
DIA2 :
Une fois à l’intérieur de la cellule, ces molécules exogènes simples sont engagées
dans des voies métaboliques et elles subissent des transformations biochimiques.
L’ensemble des voies métaboliques constituent le métabolisme cellulaire. Ces voies
métaboliques sont représentées en couleurs différentes sur la figure de gauche.
Il est important de constater que les voies métaboliques interagissent ou
« communiquent » entre-elles : des points de contact ou de transit existent entre les
différentes voies.
Chaque voie métabolique est constituée de plusieurs réactions biochimiques
successives. Dans chaque voie métabolique, au cours de chaque réaction
biochimique, la molécule produite s’appelle un métabolite. Ces voies métaboliques
peuvent être comparées au plan de métro/RER d’une grande ville comme Paris : il
existe de nombreuses lignes de métro/voies métaboliques qui sillonnent la ville et la
possibilité existe pour les passagers/métabolites de changer de ligne à certaines
stations/points de contact ou de transit.
Les voies métaboliques peuvent être linéaires ou circulaires (figure de droite). Dans
le premier cas, la voie métabolique transforme un substrat ou réactif X en un produit
Y en plusieurs réactions biochimiques. Dans le second cas, le substrat Y subit de
nombreuses transformations biochimiques pour revenir après un cycle à ce même
substrat Y ; on parle alors de cycle métabolique. Un des cycles les plus connus est le
cycle de Krebs.
DIA3 :
On distingue deux grandes classes de voies métaboliques dans la cellule : les voies
cataboliques, où les molécules simples subissent des transformations chimiques qui
conduisent à des produits finaux très pauvres en énergie (CO2, H2O, NH3,…) et à la
production d’énergie dans la cellule, et les voies anaboliques qui permettent la
synthèse de molécules endogènes complexes (protéines, acides nucléiques, lipides
complexes, glycogène) mais qui nécessitent une consommation d’énergie.
De manière très simplifiée, les molécules simples qui rentrent dans les voies
métaboliques cellulaires participent donc à la synthèse de molécules endogènes
complexes (c'est-à-dire qu’elles servent de matériaux de construction) ET à la
production d’énergie dans la cellule, énergie nécessaire notamment pour cette
synthèse.

2
N’oublions pas que les molécules endogènes complexes subissent aussi des
transformations chimiques dans la cellule et rentrent donc aussi dans des voies
cataboliques (ex : le glycogène, un polymère de glucose qui sert de stock cellulaire,
est dégradé en glucose lors du jeûne ; les protéines endogènes ont un temps de
demi-vie limité et sont donc catabolisées à plus ou moins long terme).
DIA4 :
Cette figure résume l’antagonisme des voies métaboliques cataboliques et
anaboliques, productrices et consommatrices d’énergie. Cette énergie chimique est
constituée des molécules d’ATP, de NADPH, NADH et FADH2 sur lesquelles nous
reviendrons dans la suite du cours.
DIA5 :
Les voies métaboliques sont localisées dans des compartiments cellulaires
spécifiques. Par exemple :
- noyau : synthèse d’acides nucléiques (ADN, ARNm)
- mitochondrie : cycle de Krebs, phosphorylation oxydative, oxydation des acides
gras, quelques réaction de la gluconéogénèse…
- cytosol : glycolyse, synthèse des acides gras, quelques réactions de la
gluconéogénèse
- ribosome : synthèse de protéines
- granules de glycogène : synthèse du glycogène
- réticulum endoplasmique : synthèse de lipides et de stéroïdes
Toutes les voies métaboliques ne sont pas actives dans tous les types cellulaires.
Par exemple, la néoglucogenèse se déroule exclusivement dans le foie, le rein et
l’intestin grêle.
Les conditions physiologiques d’activation ou d’inactivation de l’une ou l’autre voie
métabolique sont par exemple : le jeûne><la prise de nourriture ; l’exercice
physique><le repos,…
DIA6 :
Il est important ici de relire attentivement le chapitre 7 du cours de BA2 sur les
réactions enzymatiques donné par le Prof. F. Bureau pour comprendre la suite…
Il existe donc des voies cataboliques qui fournissent de l’énergie à la cellule et des
voies anaboliques qui consomment cette énergie. L’unité de base des voies
métaboliques étant la réaction biochimique, il est important d’identifier au sein de ces
voies, les réactions biochimiques qui conduisent à une production d’énergie, de
travail ou de chaleur (les réactions exergoniques, qui libèrent des Joules, unité
d’énergie) et celles qui en consomment (les réactions endergoniques, qui
consomment des Joules). Les premières, celles qui libèrent de l’énergie, se déroulent
spontanément, alors que les secondes ne sont pas spontanées: elles ne se
déroulent que si la cellule fournit de l’énergie ou du travail.
Le physicien américain Josiah Willard GIBBS a introduit une nouvelle fonction d’état,
l’énergie libre de Gibbs de x, ou Gx (unité : Joule/mole), qui mesure l’énergie, le
travail, la chaleur que pourrait libérer une mole de x. Gx dépend donc de la nature de
la molécule X ( càd de la qualité et de la quantité des liaisons chimiques qui unissent
les différents atomes qui composent la molécule X).

3
DIA7 :
Cette nouvelle mesure, l’énergie libre G, va nous permettre de définir si une réaction
biochimique est exergonique ou endergonique, c'est-à-dire si elle est spontanée ou
pas.
Soit une réaction biochimique S ↔ P
A S et à P sont associées une énergie libre Gs et Gp qui les caractérise.
Si la réaction biochimique implique plusieurs S et plusieurs P, comme par exemple
S1 + S2 ↔ P1 + P2
alors, nous devrons considérer l’énergie libre totale Gs = Gs1 + Gs2 à gauche de la
flèche et l’énergie totale Gp = Gp1 + Gp2 à droite de la flèche. Gs et Gp représentent
donc la somme des énergies libres de chaque molécule à gauche et à droite de la
flèche.
Rapportons les énergies libres Gs et Gp sur un diagramme avec en abscisse R, la
progression de la Réaction biochimique, et en ordonnée G, l’énergie libre. Dans un
premier temps, concentrons nous d’abord sur le début et la fin de la réaction
biochimique, en négligeant la partie centrale.
Gp – Gs, ou ∆G (en Joule/mole), la variation de G entre la fin et le début de la
réaction, nous permet de prédire si la réaction sera exergonique, libèrera de l’énergie
et sera donc spontanée, ou si elle sera endergonique et nécessitera un apport
d’énergie provenant de la cellule pour se produire. Si ∆G = 0, le système est à
l’équilibre et il n’y a ni fourniture ni apport d’énergie et la réaction est réversible.
DIA8 :
La formule de Gibbs nous permet de calculer ∆G à partir de ∆G°’ et des
concentrations de réactifs S et P en début de réaction (i = initial).
∆G°’ est défini comme la variation d’énergie libre dans des conditions standards (°)
ET biochimiques (’), c’est à dire la variation d’énergie libre qui surviendrait dans des
conditions standards biochimiques bien définies, à savoir une pression de 1 atm (’),
une température de 25°C (’), un pH constant de 7(‘), une concentration en H2O et en
Mg constantes (‘) et une concentration initiale de 1 mole/litre (1M) pour chaque
réactif (°).
Dans ces conditions standards adaptées à la réalité biochimique de la cellule, il n’y a
pas de variation du pH (’) qui reste à ~7, et donc [H+] est et reste de 10-7M au cours
de la réaction biochimique. De même, les concentrations en H2O (’) (55,5 M) et Mg (’)
(1mM) ne changent pas au cours de la réaction biochimique dans la cellule. Donc,
par convention, dans les réactions biochimiques (’), si H+ ou H20 sont des réactifs,
on leur attribue la valeur de 1 comme concentrations molaires. Pour tous les autres
réactifs, les conditions standards biochimiques sont de 1mole/l (1M)(°).
Donc, le ∆G de la réaction S ↔ P dépend de la nature des réactifs mis en présence
(∆G°’, premier terme de la somme) et de leurs concentrations initiales réelles (en
début de réaction (t=0), second terme de la somme).
DIA9 :
Comment calculer ∆G°’ ?
On sait que lorsque la réaction est à l’équilibre, ∆G = 0. Le reste est simple…
Il y a donc une relation directe et simple entre la constante d’équilibre biochimique,
K’eq, et ∆G°’ ; donc la seule connaissance de la valeur de la constante d’équilibre
biochimique K’eq permet de prédire si la réaction biochimique est exergonique ou

4
endergonique dans les conditions standards de [S] = [P] = 1M, et donc la spontanéité
de la réaction, c'est-à-dire son sens : de S vers P ou de P vers S.
DIA10 :
Tableau de la relation entre K’eq et ∆G°’. Ce sont deux constantes qui caractérisent
les réactifs. Elles ne dépendent que de la nature des réactifs.
DIA11 :
∆G est une mesure de la distance énergétique qui sépare le système qui se trouve
dans les conditions initiales « i » du même système lorsqu’il est dans la position
d’équilibre. Donc, au fil du temps, lorsque la réaction biochimique progresse, les
concentrations initiales « i » de S et P vont changer jusqu’à atteindre les
concentrations « eq » de l’équilibre chimique. A ce moment là, ∆G = 0 et le système
ne fournit plus d’énergie ni n’en demande.
DIA12 :
C’est ∆G qui au final, dans les conditions cellulaires réelles, détermine le type de
réaction biochimique, sa spontanéité et donc son sens. En effet, dans la situation
réelle de la cellule, les concentrations des réactifs ne sont pas égales à 1M (ou très
rarement…), et donc il faut aussi tenir compte du deuxième terme de la somme qui
contient les concentrations réelles des réactifs au début de la réaction biochimique.
Donc, pour une réaction biochimique particulière, on pourrait avoir un ∆G°’>0 qui
prédit une réaction endergonique dans les conditions standards biochimiques. En
réalité, les concentrations réelles des réactifs dans la cellule sont telles que
finalement ∆G<0 et la réaction est exergonique et spontanée! Pour cela, il suffit que
2,303RTlog10[P]/[S] soit négatif et d’une valeur absolue supérieure à ∆G°’.
DIA13 et 14:
Dans la cellule, de nombreuses réactions biochimiques sont couplées. Lors du
couplage de réactions biochimiques, les ∆G°’ de chaque réaction s’additionnent pour
donner le ∆G°’ total des deux réactions couplées. Si la première est faiblement
endergonique et la suivante fortement exergonique, le couplage donnera une
réaction totale exergonique.
Dans la cellule, les réactions biochimiques endergoniques sont souvent couplées à
l’hydrolyse de l’ATP en ADP + Pi. Cette réaction d’hydrolyse de l’ATP est fortement
exergonique et libère une quantité d’énergie importante qui est nécessaire pour que
la réaction endergonique couplée se produise. Il est donc extrêmement important
pour la cellule de produire des quantités suffisantes d’ATP…A l’inverse, la réaction
de production d’ATP à partir d’ADP (= réaction fortement endergonique) est couplée
à des réactions fortement exergonique (ex : pyruvate kinase (PEP en pyruvate),
phosphoglycerate kinase (1,3 bisphosphoglycerate en 3 phosphoglycerate) et
créatine kinase (créatine phosphate en créatine)). Les réactions 6 et 7 de la
glycolyse sont aussi un exemple de couplage réactionnel.
DIA15 :
Si on examine maintenant la courbe représentant la valeur de l’énergie libre G tout
au long de la réaction biochimique, on constate qu’entre le début et la fin de la
réaction, G présente un pic de valeur très élevé : c’est l’énergie qui est
obligatoirement requise pour que la réaction progresse de S en P ; elle s’appelle
l’énergie d’activation S-P, ou ∆G*. Cette énergie doit être absorbée par le(s) réactif(s)

5
S pour atteindre un état de transition très instable. Cet état de transition ne
correspond à aucun « intermédiaire réactionnel », il correspond à un état où les
angles et longueurs des liaisons chimiques du substrat sont distordus. Cette énergie
est puisée sous forme de chaleur dans l’environnement dans lequel la réaction a lieu.
La présence d’un enzyme dans le milieu réactionnel a pour conséquence de
fortement diminuer l’énergie d’activation ∆G*, ce qui augmente fortement la vitesse
de la réaction de S vers P. Par contre, l’enzyme n’a aucune influence sur ∆G et ne
modifie donc pas le sens de la réaction !
L’enzyme agit en se liant à cet état de transition, ce qui est fortement exergonique et
diminue d’autant l’énergie d’activation. Cette énergie d’activation est une barrière
énergétique essentielle, puis qu’elle prévient la dégradation spontanée des
macromolécules cellulaires riches en énergie, comme les protéines, les
polysaccharides, les acides nucléiques et les acides gras.
DIA16 :
Les enzymes augmentent fortement la vitesse de réaction : quelques exemples…
Autre exemple :
Saccharose (ou sucrose) + H20 ↔ fructose + glucose ∆G = -29,3 kJ/mole
Malgré un ∆G très négatif qui signe une réaction très exergonique et donc très
spontanée, sans enzyme, on ne trouvera pas de fructose ni de glucose si on met du
saccharose dans un verre d’eau. Par contre, en présence d’enzyme saccharase,
~1000 réactions sont catalysées par seconde. Dans ce cas-ci, sans enzyme, la
vitesse de la réaction est nulle, car l’énergie d’activation ∆G* est très élevée.
DIA17 :
Les voies métaboliques sont finement régulées, afin de permettre la survie, la
différenciation et assurer les fonctions de la cellule. Les métabolites doivent circuler
dans ces voies dans la bonne direction et à la bonne vitesse. Comme chaque
substrat est en fait le produit de la réaction biochimique précédente, si les conditions
métaboliques ne changent pas, la vitesse v1 de la réaction précédente est égale à la
vitesse v2 de la suivante, et la concentration de S reste constante au cours du temps.
Si v1 augmente car plus de réactif A pénètre dans la voie métabolique de manière
transitoire, v2 augmentera aussi, et donc la concentration de S restera constante. Il y
a homéostasie au niveau moléculaire.
Les voies métaboliques doivent aussi pouvoir s’adapter aux changements
physiologiques plus ou moins prolongés ou transitoires (jeûne ou prise de nourriture ;
repos ou exercice physique, variation de la composition alimentaire (riche en
protéines (viande), riche en glucides (sucreries),…).
Elles doivent parfois s’adapter à des changements drastiques et définitifs, comme la
différenciation d’un type cellulaire en un autre (cellules souches de la moëlle osseuse
en globules rouges, par ex).
La régulation du flux de métabolites dans une voie métabolique se fait au niveau de
certains enzymes de cette voie. Deux grands mécanismes de régulation des
enzymes co-existent :
- ceux qui contrôlent le nombre d’enzymes, càd leur expression dans la cellule,
- ceux qui contrôlent l’activité catalytique de l’enzyme.
1. présence ou pas de signaux extracellulaires, comme les hormones (insuline), les
neurotransmetteurs (acétylcholine), les cytokines,... ; activation ou pas de facteurs de
transcription, contrôle de la transcription par les facteurs de transcription, de la
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
1
/
99
100%